人源化或嵌合CD3抗體的制作方法
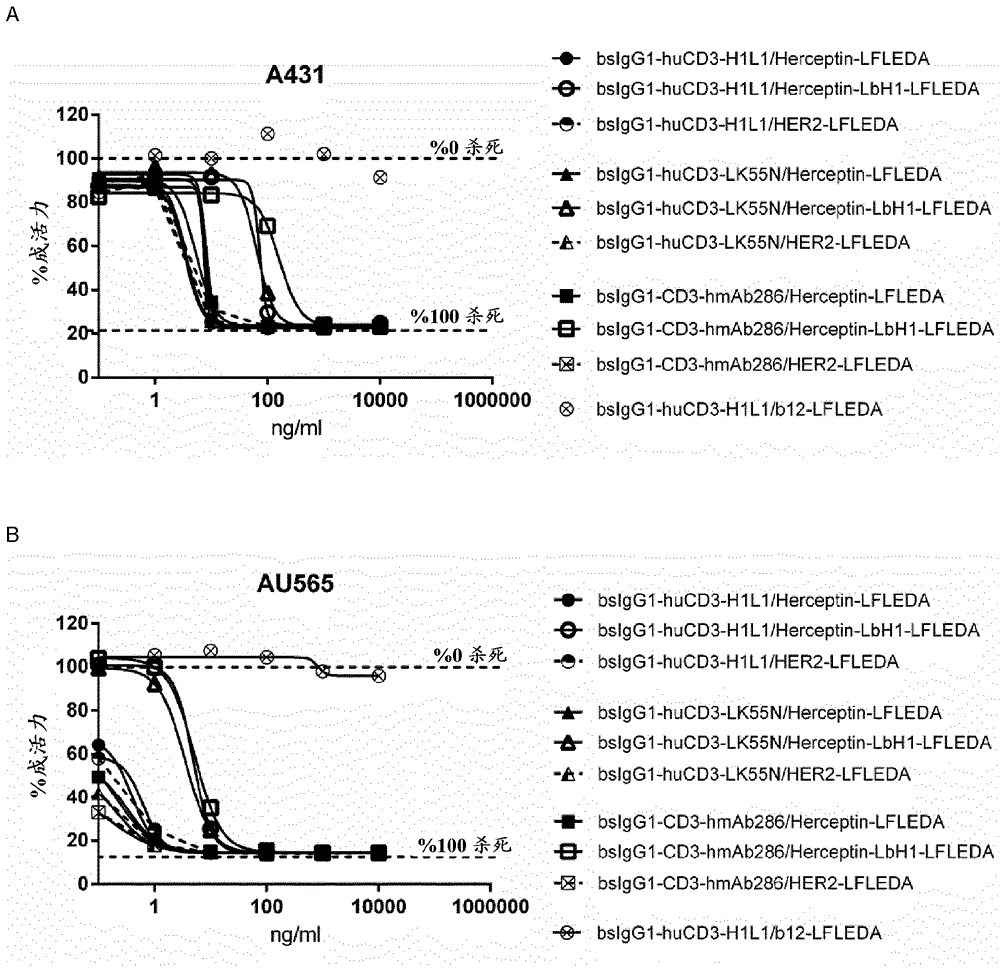
本發明涉及結合人CD3的人源化或嵌合抗體、包含所述人源化或嵌合抗體的組合物和所述人源化或嵌合抗體在治療疾病中的用途。發明背景分化簇3(CD3)已被了解很多年,和因此在許多方面是關注對象。特別是,已知針對CD3或T-細胞受體復合物(CD3作為其一部分)產生的抗體。已經描述了五種人源化OKT3效應器功能變體抗體的體外表征[1]。在缺少持續的免疫抑制藥物療法的情況下,在發生1型糖尿病后至少2年,用抗-CD3單克隆抗體hOKT3γ1(Ala-Ala)治療導致改進的C-肽反應和臨床參數[2]。改進靶向抗體療法的有前景的方法是通過遞送特別針對表達抗原的癌細胞的細胞毒性細胞。已經描述了使用T細胞以有效殺死腫瘤細胞的這一概念[3]。然而,最初的臨床研究相當令人失望,主要由于低的功效、嚴重的副作用(細胞因子爆發)和雙特異性抗體的免疫原性[4]。設計和應用雙特異性抗體的進展部分地克服了細胞因子爆發的最初障礙和改進了臨床有效性,沒有劑量限制的毒性[5]。例如,以一條臂靶向腫瘤細胞上的抗原和以另一條臂靶向例如T細胞上的CD3的某些雙特異性抗體,提供通過Fc區的Fc受體結合。在結合時,形成結合抗體Fc區的T細胞、腫瘤細胞和效應細胞的復合物,導致殺死腫瘤細胞[4]。卡妥索單抗由小鼠IgG2a/大鼠IgG2b異源二聚體組成,和已經發現在腹膜內應用后成功用于治療癌癥-相關的腹水[6]。然而,小鼠/大鼠雜合體產生免疫原性[7]和不能在人類中應用于長期靜脈內治療。頻繁治療-相關的不良事件歸因于卡妥索單抗誘導的細胞因子-釋放-相關的癥狀(即發熱、惡心、嘔吐、發冷、心動過速和低血壓)[8]-[9],這涉及到卡妥索單抗的Fc區的效應器功能。另一種抗體是厄馬索單抗(ertumaxomab)(HER2xCD3),其在具有低HER2表達的細胞系中誘導細胞毒性。厄馬索單抗已經處于對轉移性乳腺癌的II期臨床開發中[10]-[11]。已經描述了與食蟹猴和/或恒河猴CD3有交叉反應的CD3抗體[12]-[13],然而需要對所述交叉反應性抗體的進一步改進。發明簡述本發明的目標是提供人源化或嵌合CD3抗體。因此,在一個方面,本發明涉及結合人CD3的人源化或嵌合抗體,其中所述抗體包含結合區,所述結合區包含分別具有SEQIDNO:1、2和3所示的序列的重鏈可變(VH)區CDR1、CDR2和CDR3,和分別具有SEQIDNO:4所示的序列、序列GTN和SEQIDNO:5或SEQIDNO:60所示的序列的輕鏈可變(VL)區CDR1、CDR2和CDR3。在一個方面,本發明涉及結合人CD3的人源化或嵌合抗體,其中所述抗體包含結合區,所述結合區包含分別具有SEQIDNO:1、2和3所示的序列的重鏈可變(VH)區CDR1、CDR2和CDR3,和分別具有SEQIDNO:4所示的序列、序列GTN和SEQIDNO:5所示的序列的輕鏈可變(VL)區CDR1、CDR2和CDR3。在另一方面,本發明涉及雙特異性抗體,其包含本發明的抗體的第一結合區,和與所述第一抗原結合區結合不同的靶標的第二結合區。在另一方面,本發明涉及編碼一個或多個本發明的氨基酸序列的核酸構建體。在另一方面,本發明涉及表達載體,其包含(i)編碼本發明的人源化或嵌合抗體的重鏈序列的核酸序列,(ii)編碼本發明的人源化或嵌合抗體的輕鏈序列的核酸序列,或(iii)(i)和(ii)兩者。在另一方面,本發明涉及包含本發明的表達載體的宿主細胞。在另一方面,本發明涉及包含本發明的抗體或雙特異性抗體的組合物。在另一方面,本發明涉及包含本發明的抗體或雙特異性抗體和藥學上可接受的載體的藥物組合物。在另一方面,本發明涉及本發明的抗體或雙特異性抗體、組合物或藥物組合物,其用作藥物。在另一方面,本發明涉及本發明的抗體或雙特異性抗體、組合物或藥物組合物,其用于治療疾病。在另一方面,本發明涉及治療疾病的方法,包括給予有需要的受試者本發明的抗體或雙特異性抗體、組合物或藥物組合物。在一個方面,本發明涉及診斷特征為涉及或積聚表達CD3的細胞的疾病的方法,包括給予受試者本發明的人源化或嵌合抗體、組合物或藥物組合物,任選地其中所述人源化或嵌合抗體用可檢測試劑標記。在另一方面,本發明涉及用于產生本發明的抗體或雙特異性抗體的方法,包括步驟:a)培養本發明的宿主細胞,和b)從培養基純化抗體。在另一方面,本發明涉及包含本發明的抗體或雙特異性抗體的診斷組合物。在另一方面,本發明涉及用于檢測樣品中CD3抗原或表達CD3的細胞的存在情況的方法,包括步驟:a)使樣品與本發明的抗體或雙特異性抗體在允許所述抗體或雙特異性抗體和CD3之間形成復合物的條件下接觸,和b)分析是否已形成復合物。在另一方面,本發明涉及用于檢測樣品中CD3抗原或表達CD3的細胞的存在情況的試劑盒,其包含i)本發明的抗體或雙特異性抗體,和ii)試劑盒的使用說明書。在另一方面,本發明涉及結合本發明的抗體的抗個體基因型抗體。附圖簡述圖1顯示(圖1A)IgG1-huCD3的單特異性抗體變體和(圖1B)雙特異性抗體變體bsIgG1huCD3xHER2與人T細胞系Jurkat的結合曲線。顯示的數據是如實施例2所述的一個代表性實驗的平均熒光強度(MFI)。表格顯示導致半-最大結合的抗體濃度(μg/mL)(EC50)。圖2顯示(圖2A)IgG1-huCD3的單特異性抗體變體和(圖2B)雙特異性抗體變體bsIgG1huCD3xHER2與食蟹猴T細胞系HSC-F的結合曲線。顯示的數據是如實施例2所述的一個代表性實驗的平均熒光強度(MFI)。圖3:通過IgG1-huCD3抗體變體的T細胞活化。在PBMC培養物中在來自人(圖3A)和食蟹猴(圖3B)來源的T細胞上的CD69的表達通過FACS分析測量,如實施例3所述。這些實驗進行兩次,和顯示來自一個實驗的代表性結果。圖4:通過IgG1-huCD3抗體變體誘導的T-細胞增殖。人(圖4A)或食蟹猴(圖4B)PBMC用IgG1-huCD3抗體變體孵育3天,之后通過細胞增殖ELISA測量增殖,如實施例4所述。顯示來自兩個獨立實驗的代表性結果。圖5:通過具有非-激活的LFLEDA突變的huCD3抗體變體誘導人(圖5A)和食蟹猴(圖5B)T細胞介導的細胞毒性,按實施例5所示測定。顯示來自一式兩份進行的兩個獨立實驗的代表性結果。圖6顯示非-激活的IgG1-huCD3的單特異性抗體變體(圖6A)和非-激活的雙特異性抗體變體bsIgG1-huCD3xHER2(圖6B)與人T細胞系Jurkat的結合曲線。顯示的數據是如實施例2所述的一個代表性實驗的平均熒光強度(MFI)。表格顯示導致半-最大結合的抗體濃度(μg/mL)(EC50)。圖7顯示非-激活的IgG1-huCD3的單特異性抗體變體(圖7A)和非-激活的雙特異性抗體變體bsIgG1-huCD3xHER2(圖7B)與食蟹猴T細胞系HSC-F的結合曲線。顯示的數據是如實施例2所述的一個代表性實驗的平均熒光強度(MFI)。表格顯示導致半-最大結合的抗體濃度(μg/mL)(EC50)。圖8:通過非-激活的單特異性IgG1-huCD3(圖8A和B)或非-激活的雙特異性bsIgG1-huCD3xHER2抗體變體(圖8C和D)的T細胞活化。在PBMC培養物中在來自人(圖8A和C)和食蟹猴(圖8B和D)來源的T細胞上的CD69的表達通過FACS分析測量,如實施例3所述。這些實驗進行兩次和顯示來自一個實驗的代表性結果。圖9:通過非-激活的單特異性IgG1-huCD3(圖9A和B)或非-激活的雙特異性bsIgG1-huCD3xHER2抗體變體(圖9C和D)誘導的T-細胞增殖。在人(圖9A和C)或食蟹猴(圖9B和D)PBMC中測量T-細胞增殖,所述PMBC用各種抗體變體孵育3天,之后通過細胞增殖ELISA測量增殖,如實施例4所述。顯示來自兩個獨立實驗的代表性結果。圖10:通過具有非-激活的LFLEDA突變的huCD3抗體變體誘導人(圖10A)和食蟹猴(圖10B)T細胞介導的細胞毒性,如實施例5所示測定。顯示來自一式兩份進行的兩個獨立實驗的代表性結果。圖11:通過IgG1-huCD3抗體變體的恒河猴T細胞活化。在PBMC培養物中在來自恒河猴來源的T細胞上的CD69的表達通過FACS分析測量,如實施例6所述。圖12:通過非-激活的huCLB-T3/4抗體的變體的T細胞活化。對PBMC滴定IgG1-huCLB-T3/4變體。在PBMC培養物中在T細胞上的CD69的表達通過FACS分析測量,如實施例7所述。顯示了3個實驗的代表性實例。圖13:通過非-激活的huCLB-T3/4抗體的變體的T-細胞增殖。PBMC用抗體孵育3天,之后通過細胞增殖ELISA測量增殖,如實施例8所述。顯示來自兩個獨立實驗的代表性結果。圖14:通過非-激活的CD3抗體的抗體變體誘導的體外T細胞介導的細胞毒性。通過抗體變體(N297Q,LFLE,LFLENQ,LFLEDA,DANQ,LFLEDANQPS[圖14A-G])誘導T細胞介導的細胞毒性,按實施例9所示測定。顯示一式兩份進行的兩個實驗的平均值。圖15:通過非-激活的huCLB-T3/4變體誘導的體外T細胞介導的細胞毒性。通過抗體變體(LFLEDALAL[圖15A-C]誘導T細胞介導的細胞毒性,按實施例9所述測定。顯示來自一式兩份進行的一個實驗的平均值。圖16:評價C1q與非-激活的huCLB-T3/4抗體變體的結合。C1q與單特異性IgG1huCLB-T3/4(圖16A-C)和bsIgG1-huCLB-T3/4xHER2(圖B-D)及其非-激活的抗體變體的結合通過ELISA評價,如實施例10所述。圖中的結果代表了n=2實驗。圖17:非-激活的huCLB-T3/4抗體變體的藥代動力學(PK)分析與野生型IgG1-huCLB-T3/4抗體相比較,如實施例11所述。人IgG1的血漿濃度對時間作圖(圖17A)。血漿清除率按實施例11所述計算(圖17B)。水平虛線表示在SCID小鼠中人IgG1抗體的平均清除率(10mL/天/kg)。圖18:在健康HLA-型供體中陽性T細胞反應的頻率。在增殖和IL-2分泌測定法兩者中SI指數≥1.9被認為是陽性反應。人源化A33用作臨床基準對照抗體,其在臨床上顯示高水平的免疫原性和在EpiScreen測定法中常規誘導20-30%T細胞反應。包括KLH反應以檢查PBMC質量(解凍后)。圖19:本發明的人源化CD3抗體的重鏈(VH)和輕鏈(VL)可變區的序列比對。圖20:在Expi293F上清液中IgG1-huCD3-H1L1變體的表達水平,如使用抗人IgG固定的傳感器通過OctetRED所測量。圖21:IgG1-huCD3-H1L1-LFLEDA突變體與Jurkat細胞的結合。圖22:CD3雙特異性抗體變體與人T細胞的結合。圓形表示huCD3-H1L1-LFLEDA變體的結合,三角形表示huCD3-H1L1-LFLEDA-LK55N變體的結合,和方形表示CD3-hmAb286-LFLEDA變體的結合。圖23:huCD3xHER2抗體親和變體對用CD3和HER2親和變體處理的A431細胞(低HER2表達細胞)(圖23A)和AU565細胞(高HER2表達細胞)(圖23B)的細胞毒性。圖24:在NOD-SCID小鼠中通過huCD3-H1L1xHER2-LFLEDA在腫瘤接種后7、14、21和28天(圖24A)和在第29天(圖24B)得到的腫瘤大小減小。圖25:在NOD-SCID小鼠中通過huCD3-H1L1xCD20-LFLEDA在腫瘤接種后7、14和21天(圖25A)和在第21天(圖25B)得到的腫瘤大小減小。發明詳述在一個方面,本發明涉及結合人CD3的人源化或嵌合抗體,其中所述抗體包含結合區,所述結合區包含分別具有SEQIDNO:1、2和3所示的序列的重鏈可變(VH)區CDR1、CDR2和CDR3,和分別具有SEQIDNO:4所示的序列、序列GTN和SEQIDNO:5或SEQIDNO:60所示的序列的輕鏈可變(VL)區CDR1、CDR2和CDR3。在一個實施方案中,本發明涉及結合人CD3的人源化或嵌合抗體,其中所述抗體包含結合區,所述結合區包含分別具有SEQIDNO:1、2和3所示的序列的重鏈可變(VH)區CDR1、CDR2和CDR3,和分別具有SEQIDNO:4所示的序列、序列GTN和SEQIDNO:5所示的序列的輕鏈可變(VL)區CDR1、CDR2和CDR3。本文使用的術語“抗體”意指免疫球蛋白分子、免疫球蛋白分子的片段或其任一的衍生物,其在典型的生理條件下具有特異性結合抗原的能力,具有顯著時間段的半壽期,例如至少約30分鐘、至少約45分鐘、至少約1小時、至少約2小時、至少約4小時、至少約8小時、至少約12小時、約24小時或更多、約48小時或更多;約3、4、5、6、7或更多天等,或任何其它相關功能定義的時間(例如足以誘導、促進、提高和/或調節與結合抗原的抗體有關的生理反應的時間和/或抗體足以募集效應器活性的時間)。與抗原相互作用的結合區(或本文也可使用的結合結構域,兩個術語具有相同的含義),包含免疫球蛋白分子的重鏈和輕鏈兩者的可變區。抗體(Ab)的恒定區可介導免疫球蛋白與宿主組織或因子的結合,所述組織或因子包括免疫系統的各種細胞(例如效應細胞和T細胞)和補體系統的組分(例如C1q,補體活化經典途徑的第一補體)。如上所述,本文使用的術語抗體,除非另外說明或上下文明確矛盾,否則包括保留與抗原特異性相互作用(例如結合)的能力的抗體的片段。已表明抗體的抗原-結合功能可通過全長抗體的片段實現。術語"抗體"內包括的結合片段的實例包括(i)Fab’或Fab片段,一種由VL、VH、CL和CH1結構域組成的單價片段,或描述于WO2007059782(GenmabA/S)中的單價抗體;(ii)F(ab')2片段,包含在鉸鏈區通過二硫橋連接的兩個Fab片段的二價片段;(iii)基本上由VH和CH1結構域組成的Fd片段;和(iv)基本上由抗體的單臂的VL和VH結構域組成的Fv片段。此外,盡管Fv片段的兩個結構域VL和VH由單獨的基因編碼,但它們可使用重組方法通過合成的接頭連接,所述接頭使它們能夠制成單一蛋白鏈,其中VL和VH區配對形成單價分子(稱為單鏈抗體或單鏈Fv(scFv),參見例如Bird等,Science242,423-426(1988)和Huston等,PNASUSA85,5879-5883(1988))。這樣的單鏈抗體包括在術語抗體內,除非另外注明或上下文清楚指示。盡管這樣的片段通常包括在抗體的含義內,但它們共同和各自獨立地是本發明的獨特特征,顯示不同的生物學性質和功用。本發明語境中的這些和其它有用的抗體片段在本文進一步論述。還應理解,術語抗體,除非另外指示,還包括多克隆抗體、單克隆抗體(mAb)、嵌合抗體和人源化抗體,和通過任何已知技術提供的保留特異性結合抗原的能力的抗體片段(抗原-結合片段),所述技術例如酶裂解、肽合成和重組技術。產生的抗體可具有任何同種型。本文使用的術語“免疫球蛋白重鏈”、“免疫球蛋白的重鏈”或“重鏈”意指免疫球蛋白的鏈之一。重鏈通常由重鏈可變區(本文簡稱為VH)和定義了免疫球蛋白的同種型的重鏈恒定區(本文簡稱為CH)構成。重鏈恒定區通常由三個結構域CH1、CH2和CH3構成。重鏈恒定區可進一步包含鉸鏈區。本文使用的術語“免疫球蛋白”意指一類結構相關的糖蛋白,其由兩對多肽鏈組成,一對低分子量輕(L)鏈和一對重(H)鏈,所有四條鏈可能通過二硫鍵互相連接。免疫球蛋白的結構已被充分表征(參見例如[14])。在免疫球蛋白的結構內,兩條重鏈在所謂的“鉸鏈區”中通過二硫鍵互相連接。與重鏈相同,各輕鏈通常由數個區構成:輕鏈可變區(本文簡稱為VL)和輕鏈恒定區(本文簡稱為CL)。輕鏈恒定區通常包含一個結構域CL。此外,VH和VL區可進一步細分為具有超變性的區(或超變區,其可在結構確定的環的序列和/或形式中是高度可變的),亦稱為互補決定區(CDR),其與稱為框架區(FR)的更加保守的區交替。各VH和VL通常由三個CDR和四個FR構成,從氨基端至羧基端按以下順序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4(見[15])。CDR序列可通過使用IMGT[16]-[17]提供的方法測定。本文使用的術語“同種型”是指免疫球蛋白類別(例如IgG1、IgG2、IgG3、IgG4、IgD、IgA、IgE或IgM)或其任何同種異型,例如由重鏈恒定區基因編碼的IgG1m(za)和IgG1m(f)[SEQIDNO:15])。因此,在一個實施方案中,抗體包含IgG1類型或其任何同種異型的免疫球蛋白的重鏈。此外,各重鏈同種型可與kappa(κ)或lambda(λ)輕鏈組合。本文使用的術語“嵌合抗體”是指抗體,其中可變區來源于非人物種(例如來源于嚙齒動物)和恒定區來源于不同的物種,例如人。嵌合抗體可通過抗體工程產生。“抗體工程”是廣泛用于不同類型的抗體修飾的術語,和其是技術人員眾所周知的方法。具體而言,嵌合抗體可通過使用描述于[18]的標準DNA技術產生。因此,嵌合抗體可以是經遺傳學或酶學工程改造的重組抗體。產生嵌合抗體在技術人員的知識內,因此產生本發明的嵌合抗體可通過本文所述的方法之外的其它方法實現。開發用于治療應用的嵌合單克隆抗體以減少抗體免疫原性。它們可通常包含對目的抗原具有特異性的非人(例如鼠)可變區,和人恒定抗體重鏈和輕鏈結構域。在嵌合抗體的背景下使用的術語“可變區”或“可變結構域”是指包含免疫球蛋白的重鏈和輕鏈兩者的CDR和框架區的區。本文使用的術語“人源化抗體”是指經遺傳學工程改造的非人抗體,其包含人抗體恒定結構域和經修飾以包含高水平的與人可變結構域的序列同源性的非人可變結構域。這可通過移植一起形成抗原結合位點的六個非人抗體互補決定區(CDR)到同源的人受體框架區(FR)上實現(參見[19]-[20])。為了完全重建母體抗體的結合親和力和特異性,可能需要置換母體抗體(即非人抗體)的框架殘基到人框架區中(回復突變)。結構同源性建模可有助于鑒定框架區中對抗體的結合性質重要的氨基酸殘基。因此,人源化抗體可包含非人CDR序列、任選地包含一個或多個突變至非人氨基酸序列的氨基酸回復突變的基本上的人框架區和完全的人恒定區。任選地,可應用不必然是回復突變的另外的氨基酸修飾以獲得具有優選特征(例如親和力和生物化學性質)的人源化抗體。根據本發明的任何方面或實施方案的人源化或嵌合抗體可稱為“人源化或嵌合CD3抗體”、“本發明的人源化或嵌合抗體”、“CD3抗體”或“本發明的CD3抗體”,其全部具有相同的含義和目的,除非上下文另外矛盾。非人來源的抗體的氨基酸序列不同于人來源的抗體,和因此非人抗體當給予人患者時有可能產生免疫原性。然而,盡管抗體的非人來源,其CDR區段負責抗體結合其靶抗原的能力,和人源化目標在于保持抗體的特異性和結合親和力。因此,進行非人治療性抗體的人源化以使其在人中的免疫原性最小,而同時這樣的人源化抗體保持非人來源的抗體的特異性和結合親和力。本文使用的術語“結合區”是指能夠結合任何分子例如多肽(例如存在于細胞、細菌或病毒體上)的抗體的區。本文使用的術語"結合''是指抗體與預定抗原或靶標的結合,當在BIAcore3000儀器上通過例如表面等離子體共振(SPR)技術使用抗原作為配體和抗體作為分析物測定時,與它們的結合通常具有對應于約10-6M或更小、例如10-7M或更小、例如約10-8M或更小、例如約10-9M或更小、約10-10M或更小或約10-11M或甚至更小的KD的親和力,和以對應于比其結合并非預定抗原或密切相關抗原的非特異性抗原(例如BSA、酪蛋白)的親和力低至少10倍、例如低至少100倍、例如低至少1,000倍、例如低至少10,000倍、例如低至少100,000倍的KD的親和力結合預定抗原。親和力更低的程度取決于抗體的KD,以致當抗體的KD極低時(即,抗體是高度特異的),則抗原的親和力低于非特異性抗原的親和力的程度可以是至少10,000倍。本文使用的術語"KD"(M)是指特定抗體-抗原相互作用的離解平衡常數。本文使用的術語“人CD3”是指人分化簇3蛋白,其是T細胞共-受體(co-receptor)蛋白復合物的一部分,和由四種不同的鏈構成。CD3也存在于其它物種,和因此術語“CD3”可在本文中使用和不限于人CD3,除非上下文矛盾。在哺乳動物中,該復合物包含一條CD3γ(gamma)鏈(人CD3γ鏈SwissprotP09693或食蟹猴CD3γSwissprotQ95LI7)、一條CD3δ(delta)鏈(人CD3δSwissprotP04234或食蟹猴CD3δSwissprotQ95LI8)、兩條CD3ε(epsilon)鏈(人CD3εSwissprotP07766;或食蟹猴CD3εSwissprotQ95LI5)、恒河猴CD3ε(SwissprotG7NCB9),和一條CD3ζ-鏈(zeta)鏈(人CD3ζSwissprotP20963、食蟹猴CD3ζSwissprotQ09TK0)。這些鏈與稱為T-細胞受體(TCR)的分子締合,和在T淋巴細胞中產生活化信號。TCR和CD3分子一起構成TCR復合物。在技術人員的知識范圍內的是,Swissprot編號所提及的氨基酸序列包括信號肽,其在蛋白質翻譯后被除去。因此,細胞表面上存在的蛋白質,例如CD3,不包括信號肽。具體而言,表1中所列的氨基酸序列不含有這樣的信號肽。表1中所列的這樣的蛋白質可被稱為“成熟蛋白質”。因此,SEQIDNO:14顯示成熟人CD3δ(delta)的氨基酸序列,SEQIDNO:13顯示成熟人CD3ε(epsilon)的氨基酸序列,SEQIDNO:21顯示成熟食蟹猴CD3ε的氨基酸序列,和SEQIDNO:22顯示成熟恒河猴CD3ε的氨基酸序列。因此,本文使用的術語“成熟”是指不包含任何信號或前導序列的蛋白質。眾所周知的是,信號肽序列同源性、長度和切割位點位置在不同的蛋白質之間顯著不同。信號肽可通過不同的方法測定,例如本發明的SEQIDNO:13已根據SignalP應用(可獲自http://www.cbs.dtu.dk/services/SignalP/)測定。在具體的實施方案中,本發明的人源化或嵌合抗體結合CD3的ε鏈,例如人CD3的ε鏈(SEQIDNO:13)。在又一個具體的實施方案中,人源化或嵌合抗體結合人CD3ε(epsilon)(SEQIDNO:13)的N-端部分的氨基酸1-27內的表位。在這樣的具體實施方案中,抗體可甚至進一步與其它非人靈長類物種例如食蟹猴(食蟹猴CD3εSEQIDNO:21)和/或恒河猴(恒河猴CD3εSEQIDNO:22)交叉反應。本文使用的術語“交叉反應”是指抗體例如本發明的人源化或嵌合抗體結合其在不同物種上的靶標的能力。具體而言,本文所述的實施例中例舉的人源化CD3抗體具有結合人(實施例2)、食蟹猴(實施例2)和恒河猴CD3的能力。與原始抗體相比,包含本文定義的CDR序列并進一步包含框架區的本發明的抗體,可在CDR序列之外的序列上不同,但仍保留完全結合能力。因此,本發明還涉及包含與本文所述的任何序列具有一定序列同一性的可變區的氨基酸序列的抗體。在本發明的背景中使用的術語“序列同一性”是指作為所述序列共有的相同位置數的函數的兩個序列之間的同一性百分比(即%同源性=相同位置數/位置總數x100),考慮了空位數和各空位的長度,其需要為兩個序列的最佳比對而被引入。兩個核苷酸或氨基酸序列之間的同一性百分比可例如使用E.Meyers和W.Miller[21]的算法測定。此外,兩個氨基酸序列之間的同一性百分比可使用Needleman和Wunsch算法[22]測定。多重比對優選使用ClustalW算法[23]進行(例如在VectorNTIAdvance?軟件版本11.5;InvitrogenInc.中所用的)。因此,在一個實施方案中,VH區與選自以下的VH序列中所示的至少一個氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性:a)SEQIDNO:6所示的VH序列;b)SEQIDNO:8所示的VH序列;c)SEQIDNO:7所示的VH序列;和d)SEQIDNO:9所示的VH序列。在一個具體的實施方案中,VH區與選自以下的VH序列中所示的至少一個氨基酸序列具有至少96%氨基酸序列同一性:a)SEQIDNO:6所示的VH序列;b)SEQIDNO:8所示的VH序列;c)SEQIDNO:7所示的VH序列;和d)SEQIDNO:9所示的VH序列。在一個實施方案中,VL區與選自以下的VL序列中所示的至少一個氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性:a)SEQIDNO:10所示的VL序列;b)SEQIDNO:11所示的VL序列;和c)SEQIDNO:12所示的VL序列。在一個具體的實施方案中,VL區與選自以下的VL序列中所示的至少一個氨基酸序列具有至少95%氨基酸序列同一性:a)SEQIDNO:10所示的VL序列;b)SEQIDNO:11所示的VL序列;和c)SEQIDNO:12所示的VL序列。在一個實施方案中,VH區選自:a)SEQIDNO:6所示的VH序列;b)SEQIDNO:8所示的VH序列;c)SEQIDNO:7所示的VH序列;和d)SEQIDNO:9所示的VH序列。在一個實施方案中,VL區選自:a)SEQIDNO:10所示的VL序列;b)SEQIDNO:11所示的VL序列;和c)SEQIDNO:12所示的VL序列。在一個實施方案中,VH或VL序列中的只有一個與本文公開的序列之一100%相同,而另一個可具有與本文公開的序列之一至少90%、至少95%、至少97%或至少99%氨基酸序列同一性的序列同一性。在一個具體的實施方案中,VH序列與選自以下的VH序列中所示的至少一個氨基酸序列具有至少97%氨基酸序列同一性:a)SEQIDNO:6所示的VH序列;b)SEQIDNO:7所示的VH序列;c)SEQIDNO:8所示的VH序列;和d)SEQIDNO:9所示的VH序列;和VL序列與選自以下的VL序列中所示的至少一個氨基酸序列具有至少95%氨基酸序列同一性:i.SEQIDNO:10所示的VL序列;ii.SEQIDNO:11所示的VL序列;和iii.SEQIDNO:12所示的VL序列。在一個實施方案中,VH和VL序列選自:a)與分別SEQIDNO:6和10;分別7和10;分別8和10;分別9和10;分別6和11;分別7和11;分別8和11;分別9和11;分別6和12;分別7和12;分別8和12;和分別9和12所示的序列具有至少90%同一性的VH和VL序列;b)與分別SEQIDNO:6和10;分別7和10;分別8和10;分別9和10;分別6和11;分別7和11;分別8和11;分別9和11;分別6和12;分別7和12;分別8和12;和分別9和12所示的序列具有至少95%同一性的VH和VL序列;c)與分別SEQIDNO:6和10;分別7和10;分別8和10;分別9和10;分別6和11;分別7和11;分別8和11;分別9和11;分別6和12;分別7和12;分別8和12;和分別9和12所示的序列具有至少97%同一性的VH和VL序列;d)與分別SEQIDNO:6和10;分別7和10;分別8和10;分別9和10;分別6和11;分別7和11;分別8和11;分別9和11;分別6和12;分別7和12;分別8和12;和分別9和12所示的序列具有至少99%同一性的VH和VL序列;e)與分別SEQIDNO:6和10;分別7和10;分別8和10;分別9和10;分別6和11;分別7和11;分別8和11;分別9和11;分別6和12;分別7和12;分別8和12;和分別9和12所示的序列具有至少100%同一性的VH和VL序列;f)與SEQIDNO:6所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;g)與SEQIDNO:6所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;h)與SEQIDNO:6所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;i)與SEQIDNO:6所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;j)與SEQIDNO:6所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;k)與SEQIDNO:6所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;l)與SEQIDNO:6所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;m)與SEQIDNO:6所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;n)與SEQIDNO:6所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;o)與SEQIDNO:6所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;p)與SEQIDNO:6所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;q)與SEQIDNO:6所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;r)與SEQIDNO:6所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;s)與SEQIDNO:6所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;t)與SEQIDNO:6所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;u)與SEQIDNO:6所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;v)與SEQIDNO:6所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;x)與SEQIDNO:6所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;y)與SEQIDNO:6所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;z)與SEQIDNO:6所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;aa)與SEQIDNO:7所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;ab)與SEQIDNO:7所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;ac)與SEQIDNO:7所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;ad)與SEQIDNO:7所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;ae)與SEQIDNO:7所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;af)與SEQIDNO:7所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;ag)與SEQIDNO:7所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;ah)與SEQIDNO:7所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;ai)與SEQIDNO:7所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;aj)與SEQIDNO:7所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;ak)與SEQIDNO:7所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;al)與SEQIDNO:7所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;am)與SEQIDNO:7所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;an)與SEQIDNO:7所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;ao)與SEQIDNO:7所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;ap)與SEQIDNO:7所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;aq)與SEQIDNO:7所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;ar)與SEQIDNO:7所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;as)與SEQIDNO:7所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;at)與SEQIDNO:7所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;ba)與SEQIDNO:8所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;bb)與SEQIDNO:8所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;bc)與SEQIDNO:8所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;bd)與SEQIDNO:8所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;be)與SEQIDNO:8所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;bf)與SEQIDNO:8所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;bg)與SEQIDNO:8所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;bh)與SEQIDNO:8所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;bi)與SEQIDNO:8所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;bj)與SEQIDNO:8所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;bk)與SEQIDNO:8所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;bl)與SEQIDNO:8所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;bm)與SEQIDNO:8所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;bn)與SEQIDNO:8所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;bo)與SEQIDNO:8所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;bp)與SEQIDNO:8所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;bq)與SEQIDNO:8所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;br)與SEQIDNO:8所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;bs)與SEQIDNO:8所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;bt)與SEQIDNO:8所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;ca)與SEQIDNO:9所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;cb)與SEQIDNO:9所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;cc)與SEQIDNO:9所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;cd)與SEQIDNO:9所示的序列具有至少90%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;ce)與SEQIDNO:9所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;cf)與SEQIDNO:9所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;cg)與SEQIDNO:9所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;ch)與SEQIDNO:9所示的序列具有至少95%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;ci)與SEQIDNO:9所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;cj)與SEQIDNO:9所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;ck)與SEQIDNO:9所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列;cl)與SEQIDNO:9所示的序列具有至少97%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;cm)與SEQIDNO:9所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;cn)與SEQIDNO:9所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;co)與SEQIDNO:9所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;cp)與SEQIDNO:9所示的序列具有至少99%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少100%同一性的VL序列;cq)與SEQIDNO:9所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少90%同一性的VL序列;cr)與SEQIDNO:9所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少95%同一性的VL序列;cs)與SEQIDNO:9所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少97%同一性的VL序列;和ct)與SEQIDNO:9所示的序列具有至少100%同一性的VH序列和與SEQIDNO:10、11或12所示的序列具有至少99%同一性的VL序列。在一個實施方案中,結合區包含選自以下的VH和VL:a)SEQIDNO:6所示的VH序列,和SEQIDNO:10所示的VL序列;b)SEQIDNO:8所示的VH序列,和SEQIDNO:10所示的VL;c)SEQIDNO:9所示的VH序列,和SEQIDNO:10所示的VL序列;d)SEQIDNO:6所示的VH序列,和SEQIDNO:11所示的VL序列;e)SEQIDNO:6所示的VH序列,和SEQIDNO:12所示的VL序列;f)SEQIDNO:7所示的VH序列,和SEQIDNO:10所示的VL序列;g)SEQIDNO:7所示的VH序列,和SEQIDNO:11所示的VL序列;h)SEQIDNO:7所示的VH序列,和SEQIDNO:12所示的VL序列;i)SEQIDNO:8所示的VH序列,和SEQIDNO:11所示的VL序列;j)SEQIDNO:8所示的VH序列,和SEQIDNO:12所示的VL序列;k)SEQIDNO:9所示的VH序列,和SEQIDNO:11所示的VL序列;和l)SEQIDNO:9所示的VH序列,和SEQIDNO:12所示的VL序列。在具體的實施方案中,結合區包含選自以下的VH序列和VL序列:a)SEQIDNO:6所示的VH序列,和SEQIDNO:10所示的VL序列;b)SEQIDNO:8所示的VH序列,和SEQIDNO:10所示的VL序列;和c)SEQIDNO:9所示的VH序列,和SEQIDNO:10所示的VL序列。本發明的人源化抗體可通過比較重鏈和輕鏈可變區氨基酸序列與人種系可變區序列的數據庫,以鑒定具有合適的同源性程度的重鏈和輕鏈人序列用作人可變框架區而產生。可通過移植例如鼠CDR到框架區上(按上文所述鑒定)并且如果需要的話,通過回復突變(框架區中在指定位置上的一個或多個人氨基酸殘基突變回到非人氨基酸)成可能對恢復抗體結合功效是關鍵的鑒定的特定鼠殘基序列,來設計一系列人源化重鏈和輕鏈可變區。然后按應用計算機技術:iTopeTM和TCEDTM([24]、[25]和[26])所測定的,選擇具有最低發生率的可能T細胞表位的變體序列。此外,本發明的人源化抗體也可以是“去免疫的”。去免疫可能是需要的,因為在蛋白序列例如本發明的人源化抗體內,當它們具有激活輔助T細胞的潛力時人T細胞表位的存在可增加免疫原性風險特征。輔助T細胞的這樣的活化可通過去免疫而避免。去免疫可通過引入突變至人源化抗體的氨基酸序列進行,以除去T細胞表位而不顯著減少抗體的結合親和力。因此,在本發明的一個實施方案中,人源化抗體可通過包括以下步驟的方法產生:(i)比較非人完全可變重鏈序列和/或完全可變輕鏈序列與人種系序列的數據庫,(ii)選擇與非人序列具有最高同源性的人種系序列,以獲得人源化序列,(iii)如果需要的話,通過回復突變優化人源化序列,和(iv)在合適的表達系統中表達序列。因此,本發明的全長抗體可通過包括以下步驟的方法產生:(i)比較非人可變重鏈序列和可變輕鏈序列與人種系序列的數據庫,(ii)選擇與非人序列具有最高同源性的人種系序列,(iii)移植非人CDR至選擇的人種系,以獲得人源化序列,(iv)如果需要的話,通過回復突變優化人源化序列,(v)鑒定恒定重鏈和輕鏈序列,和(vi)在合適的表達系統中表達完全重鏈序列和完全輕鏈序列。本發明的全長抗體因此可按實施例1所述產生。在技術人員的知識范圍內的是,從CDR序列或完全可變區序列開始,產生全長抗體。因此,技術人員將知道如何產生本發明的全長抗體。本文使用的術語“完全重鏈序列”是指由可變重鏈和恒定重鏈序列組成的序列。本文使用的術語“完全輕鏈序列”是指由可變輕鏈和恒定輕鏈序列組成的序列。回復突變可通過標準DNA誘變引入。用于DNA誘變的這樣的標準技術描述于[18]。或者,使用市售可得的試劑盒例如QuickchangeTM定點誘變試劑盒(Stratagene),或需要的回復突變可通過從頭的DNA合成引入。因此,在一個實施方案中,抗體是人源化抗體。嵌合抗體可通過用人來源的恒定區序列置換非人(例如鼠)抗體的所有恒定區序列產生。因此,完全非人可變區序列保留在嵌合抗體中。因此,本發明的嵌合抗體可通過包括以下步驟的方法產生:在合適的表達系統中表達非人可變重鏈(SEQIDNO:27)、非人可變輕鏈序列(SEQIDNO:28)、人恒定重鏈和人恒定輕鏈序列,和從而產生全長嵌合抗體。可使用備選方法。產生嵌合抗體的這樣的方法在技術人員的知識范圍內,和因此技術人員將知道,如何產生本發明的嵌合抗體。因此,在一個實施方案中,抗體是嵌合抗體。在一個實施方案中,抗體是全長抗體。本文使用的術語“全長抗體”是指包含對應于在該同種型的野生型抗體中天然存在的那些的所有重鏈和輕鏈恒定和可變結構域的抗體(例如母體或變體抗體)。在一個實施方案中,抗體包含Fc區,所述Fc區包含第一和第二免疫球蛋白重鏈。本文使用的術語“Fc區”是指在從N-端至C-端的方向上包含至少鉸鏈區、CH2區和CH3區的區。Fc區可進一步包含在鉸鏈區的N-端的CH1區。本文使用的術語“鉸鏈區”是指免疫球蛋白重鏈的鉸鏈區。因此,例如人IgG1抗體的鉸鏈區對應于根據Kabat中所述的Eu編號的氨基酸216-230。除非另外說明或上下文矛盾,否則恒定區序列的氨基酸在本文中根據Eu-編號索引進行編號(描述于[27])和可被稱為“根據Kabat中所述的Eu編號”、“根據Kabat的Eu編號”或“根據Eu編號系統”。本文使用的術語“CH1區”或“CH1結構域”是指免疫球蛋白重鏈的CH1區。因此,例如人IgG1抗體的CH1區對應于根據Eu編號系統的氨基酸118-215。然而,CH1區也可以是本文所述的任何其它的亞型。本文使用的術語“CH2區”或“CH2結構域”是指免疫球蛋白重鏈的CH2區。因此,例如人IgG1抗體的CH2區對應于根據Eu編號系統的氨基酸231-340。然而,CH2區也可以是本文所述的任何其它的亞型。本文使用的術語“CH3區”或“CH3結構域”是指免疫球蛋白重鏈的CH3區。因此,例如人IgG1抗體的CH3區對應于根據Eu編號系統的氨基酸341-447。然而,CH3區也可以是本文所述的任何其它的亞型。在一個實施方案中,免疫球蛋白重鏈的同種型選自IgG1、IgG2、IgG3和IgG4。免疫球蛋白重鏈可以是在各個免疫球蛋白類型內的任何同種異型,例如IgG1m(f)(SEQIDNO:15)。因此,在一個具體的實施方案中,免疫球蛋白重鏈的同種型是IgG1或其任何同種異型,例如IgG1m(f)(SEQIDNO:15)。當靶向作為T-細胞受體(TCR)的一部分的抗原CD3時,細胞殺死的T細胞特有機制是理想的。其它效應器功能,例如補體活化,可能是不需要的,和因此降低效應器功能是理想的。C1q結合是補體級聯中的第一步,和因此用作抗體的補體依賴性細胞毒性(CDC)能力的指示物。如果C1q與抗體的結合可被避免,則補體級聯的活化也可被避免。因此,在一個實施方案中,抗體包含已被修飾的Fc區,使得C1q與所述抗體的結合與野生型抗體相比減少至少70%、至少80%、至少90%、至少95%、至少97%、至少99%或100%,其中C1q結合通過ELISA測定。本文使用的術語“修飾”是指與野生型Fc區的氨基酸序列不相同的Fc區的氨基酸序列。即,在野生型Fc區的指定位置的氨基酸殘基已經被置換、缺失或插入,以改變例如對C1q的結合位點、對其它效應分子的結合位點或與Fc受體(FcR)的結合。氨基酸序列的這樣的修飾可通過用保守氨基酸置換一個或多個氨基酸制備,或可通過用與野生型中存在的氨基酸在物理和/或功能上類似的可選擇的氨基酸置換一個或多個氨基酸制備。置換也可通過用非保守氨基酸置換來制備。在本發明的背景下,氨基酸可描述為保守或非保守氨基酸,和可因此相應地分類。氨基酸殘基還可分為通過可選擇的物理和功能性質定義的類型。因此,氨基酸的類型可在一個或兩個以下表格中反映:保守類型的氨基酸殘基酸性殘基D和E堿性殘基K、R和H親水不帶電荷殘基S、T、N和Q脂族不帶電荷殘基G、A、V、L和I非極性不帶電荷殘基C、M和P芳族殘基F、Y和W氨基酸殘基的可選擇的物理和功能分類含醇基的殘基S和T脂族殘基I、L、V和M環烯基-相關殘基F、H、W和Y疏水殘基A、C、F、G、H、I、L、M、R、T、V、W和Y帶負電荷殘基D和E極性殘基C、D、E、H、K、N、Q、R、S和T帶正電荷殘基H、K和R小殘基A、C、D、G、N、P、S、T和V極小殘基A、G和S參與轉角形成的殘基A、C、D、E、G、H、K、N、Q、R、S、P和T柔性殘基Q、T、K、S、G、P、D、E和R在本發明的背景下,抗體例如人源化或嵌合抗體中的置換如下表示:原始氨基酸–位置–置換的氨基酸;參照公認的氨基酸命名法,使用三字母代碼或單字母代碼,包括代碼Xaa和X以指示任何氨基酸殘基。因此,符號“L234F”或“Leu234Phe”意思是抗體包含在氨基酸位置234上亮氨酸被苯丙氨酸置換。在給定位置上氨基酸置換為任何其它氨基酸如下表示:原始氨基酸–位置;或例如“L234”。對于其中原始氨基酸和/或置換的氨基酸可包含一個以上但并非全部氨基酸的修飾,所述一個以上的氨基酸可通過“,”或“/”分開。例如在位置234上置換亮氨酸為苯丙氨酸、精氨酸、賴氨酸或色氨酸:“Leu234Phe,Arg,Lys,Trp”或“Leu234Phe/Arg/Lys/Trp”或“L234F,R,K,W”或“L234F/R/K/W”或“L234至F,R,K或W”。在本發明的背景下這樣的命名可互換使用,但具有相同的含義和目的。此外,術語“置換”包括置換成其它19種天然氨基酸中的任一個,或其它氨基酸,例如非天然氨基酸。例如,置換位置234上的氨基酸L包括以下各種置換:234A、234C、234D、234E、234F、234G、234H、234I、234K、234M、234N、234Q、234R、234S、234T、234V、234W、234P和234Y。即,通過這種方式,等同于命名234X,其中X指示除了原始氨基酸之外的任何氨基酸。這些置換也可稱為L234A,L234C等,或L234A,C等,或L234A/C/等。所述命名類似地適用于本文提及的各個和全部位置,本文特別包括這樣的置換中的任一個。本發明的抗體還可包含氨基酸殘基的缺失。這樣的缺失可表示為“del”,和包括例如書寫為L234del。因此,在這樣的實施方案中,位置234上的亮氨酸從氨基酸序列中缺失。術語“氨基酸”和“氨基酸殘基”在本文可互換使用。本文使用的術語“C1q結合”是指當抗體結合至其抗原時C1q與所述抗體結合。本文使用的術語“結合至其抗原”是指抗體與其抗原在體內和體外的結合。本文使用的術語“減少”當涉及C1q結合時,是指當與C1q與野生型抗體的結合相比,本發明的抗體減少、最小化或甚至完全抑制C1q與抗體結合的能力。本文使用的術語“野生型抗體”涉及在本發明的抗體的比較測定法中使用時,是指除了并非無活性之外與待測試的抗體相同的抗體。在該背景下,術語“無活性”是指修飾的Fc區具有減少或無C1q結合,如實施例10所測定,即在C1q結合通過ELISA測定時,如實施例4測定(即T-細胞增殖在基于外周血單核細胞(PBMC)的功能測定法中測量)的減少或無Fc-介導的T-細胞增殖;和/或如實施例3測定(即Fc-介導的CD69表達在基于PBMC的功能測定法中測定)的減少或無Fc-介導的CD69表達。因此,野生型抗體包含在免疫球蛋白重鏈中天然存在的氨基酸,即不包含任何氨基酸修飾的抗體,所述修飾可改變或減少抗體與例如C1q、Fc受體等相互作用的能力。因此,這樣的野生型抗體將保持為能夠結合例如C1q的活化抗體。野生型抗體和本發明的抗體可包含并非影響抗體誘導效應器功能的能力的那些的氨基酸修飾,以將抗體制備成雙特異性抗體等。本文使用的術語“ELISA”是指酶聯免疫吸附測定法,其為使用抗體和顏色變化來鑒定物質的試驗。第一特異性抗體連接至平板表面。藉此加入來自樣品的蛋白,其中測試與所述第一特異性抗體的結合。加入結合來自樣品的抗體的第二抗體。第二抗體與酶連接,并且在最終步驟中加入包含酶的底物的物質。隨后的反應產生可檢測信號,最常見的是底物的顏色變化。ELISA方法的概念是本領域眾所周知的,和進行ELISA的各種方式被視為評價本發明的抗體的方法的一部分。因此,該解釋不應理解為限制,因為可進行各種形式的ELISA,例如描述于實施例4。特別是,本發明的抗體結合C1q的能力可通過ELISA測定,包括以下步驟:(i)包被所述抗體到96-孔板上,(ii)加入3%血清,(iii)加入抗-人C1q抗體,(iv)將板顯色,和(v)測量OD405nm。因此,在一個實施方案中,抗體包含已被修飾的Fc區,使得C1q與所述抗體的結合與野生型抗體相比減少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q結合通過ELISA測定,包括以下步驟:(i)包被所述抗體到96-孔板上,(ii)加入3%血清,(iii)加入抗-人C1q,(iv)將板顯色,和(v)測量OD405nm。因此,在具體的實施方案中,C1q的結合按實施例10中所述評價。本文使用的術語“Fc受體”或“FcR”是指存在于某些細胞的表面上的蛋白質。FcR結合抗體的Fc區。存在數種不同類型的FcR,其根據它們識別的抗體的類型分類。例如Fcγ(gamma)受體結合IgG類型的抗體。本文使用的術語“Fcγ受體”、“Fcgamma受體”或“FcγR”是指屬于免疫球蛋白超家族的一組Fc受體,和對于誘導調理(包覆)微生物的吞噬作用是最重要的Fc受體。該家族包括幾個成員,FcγRI(CD64)、FcγRIIa(CD32a)、FcγRIIb(CD32b)、FcγRIIIa(CD16a)、FcγRIIIb(CD16b),它們由于不同的分子結構而在抗體親和力上不同。Fc-介導的效應器功能形成人免疫球蛋白G(IgG)分子的生物活性的一部分。這樣的效應器功能的實例包括例如抗體依賴性細胞-介導的細胞毒性(ADCC)和補體依賴性細胞毒性(CDC),其通過各種效應分子與Fc區結合而觸發。在本發明的背景下,“Fc結合”、“Fc受體結合”、“FcR結合”和“抗體Fc區與FcR結合”是指Fc區與Fc受體(FcR)或效應分子結合。術語“FcγR結合”和“FcγRI結合”是指分別結合至或以Fc區結合至Fcgamma受體和Fcgamma受體I。當CD3抗體結合T細胞時,CD3抗體的野生型Fc區結合至其它細胞(例如單核細胞)上存在的FcR,這導致非特異性的Fc-介導的T細胞活化。這樣的非特異性的Fc-介導的T細胞活化可能是不需要的。T細胞也可被靶向的或靶標特異性的T細胞活化激活。對于許多適應癥例如癌癥的治療,這樣的靶向的T細胞活化可為高度需要的。本文使用的術語“靶向的T細胞活化”是指通過使用雙特異性抗體指導T細胞至特定細胞例如腫瘤細胞,所述雙特異性抗體包含結合特定靶標例如腫瘤細胞上的腫瘤靶標的第一結合區,和結合T細胞特異性靶標例如CD3的第二結合區。因此,T細胞靶向至特定細胞例如腫瘤細胞,可通過使用雙特異性抗體而促進,其中結合區之一結合T細胞上存在的CD3和另一結合區結合靶標特異性抗原,例如腫瘤細胞上的靶標特異性抗原。盡管如此,非特異性的Fc-介導的T細胞活化可能仍然存在,和因此通過Fc-介導的交聯的這樣的不需要的非特異性的Fc-介導的T細胞活化應該被避免,和通過制備對這樣的活性而言是無活性的Fc區可能是需要的。因此,所述無活性Fc區與存在的Fc受體之間的相互作用被阻止。當在幾種不同的測定法(即參見實施例3-5)中測試時本發明的人源化抗體已經證明是無活性的。包含Fc區的氨基酸修飾的另一測試的CD3抗體huCLB-T3/4當在不同的測定法(即參見實施例7-10)中測試時也證明是無活性的。如實施例中所述的包含氨基酸置換L234F、L235E和D265A的本發明的人源化CD3抗體顯示在T細胞上低水平的CD69表達(實施例3)、Fc-介導的T-細胞增殖的廢除(實施例4)和當呈雙特異性抗體的形式時無非特異性靶標殺傷(實施例5)。因此,本發明的人源化抗體當與野生型抗體相比時在幾種測定法中顯示優異的結果。本發明的抗體可包含Fc區的修飾。當抗體包含這樣的修飾時,其可變成無活性或非-激活的抗體。本文使用的術語“無活性”、“無活性的”或“非-激活的”是指至少不能結合任何Fcγ受體、誘導Fc-介導的FcR交聯或通過單個抗體的兩個Fc區誘導FcR-介導的靶抗原交聯,或不能結合C1q的Fc區。人源化或嵌合CD3抗體的Fc區的無活性合適地使用單特異性形式的抗體測試,但是如此鑒定的無活性Fc區可以雙特異性或其它人源化或嵌合多特異性CD3抗體使用。可構建幾種變體以制備對與Fcgamma受體和C1q的相互作用無活性的抗體的Fc區,用于治療性抗體開發。這樣的變體的實例在本文描述。因此,在一個實施方案中,抗體包含已被修飾的Fc區,使得與野生型抗體相比,所述抗體介導減少的Fc-介導的T-細胞增殖,減少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T-細胞增殖在基于外周血單核細胞(PBMC)的功能測定法中測量。本文使用的術語“減少”是指當與對照蛋白質例如抗體相比活性或表達減少。具體而言,術語“減少”當涉及T-細胞增殖時,是指當與通過野生型抗體結合的T細胞增殖相比,本發明的抗體減少、最小化或甚至完全抑制T細胞增殖的能力。抗體減少T-細胞增殖的能力可通過基于PBMC的功能測定法評價,如實施例4和實施例8中所述。在一個實施方案中,用人PBMC進行測定法。在另一實施方案中,用食蟹猴PBMC進行測定法。在又一實施方案中,用恒河猴PBMC進行測定法。由于本發明的抗體有交叉反應性,本文所述的基于PBMC的測定法可用任何物種的PBMC進行以顯示T-細胞增殖的減少,只要使用的物種的PBMC在抗體的交叉反應性譜內,例如人、食蟹猴或恒河猴。本文使用的術語“基于外周血單核細胞(PBMC)的功能測定法”是指用于評價本發明的抗體的功能特征,例如所述抗體影響T-細胞增殖或CD69表達的能力的測定法,其中存在的唯一細胞是外周血單核細胞。因此,在一個實施方案中,T-細胞增殖通過包括以下步驟的方法測量:用范圍1-1000ng/mL的抗體在37℃在5%(vol/vol)CO2潮濕孵育器中孵育PBMC三天;加入化合物,例如BrdU,其摻入至增殖的細胞的DNA;孵育5小時,沉淀細胞,干燥細胞,任選地在4℃貯存細胞,包被細胞到ELISA板,在室溫下用抗-BrdU-過氧化物酶孵育90分鐘,用1mg/mL2,2’-連氮基-雙(3-乙基苯并噻唑啉-6-磺酸)顯色約30分鐘,加入100μL2%草酸終止反應,和在合適的微板閱讀器中測量405nm的吸光度。本文使用的術語“增殖”是指在細胞分裂的背景下的細胞生長。本文使用的術語“BrdU”是指5-溴-2’-脫氧尿苷,其是胸苷的同系物。當BrdU加入細胞培養物中一段有限的時間(例如4小時)時,其將摻入增殖的細胞的DNA中。在固定細胞后,可在ELISA中使用抗-BrdU-過氧化物酶進行摻入的BrdU檢測。BrdU摻入因此是增殖的度量。在一個實施方案中,抗體包含已被修飾的Fc區,使得與野生型抗體相比,所述抗體減少Fc-介導的CD69表達至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc-介導的CD69表達在基于PBMC的功能測定法中測定。本文使用的術語“減少”是指與對照蛋白質例如抗體相比,活性或表達的減少。具體而言,術語“減少”當涉及T細胞活化標記物CD69的表達水平時,是指與當T細胞被野生型抗體結合時(條件是抗體兩個結合區均結合CD3)CD69的表達水平相比,CD69的表達水平減少。抗體減少CD69表達的能力可通過基于PBMC的功能測定法評價,如實施例3和實施例7所述。因此,在一個實施方案中,CD69的表達通過包括以下步驟的方法測量:用范圍1-1000ng/mL的抗體在37℃在5%(vol/vol)CO2潮濕孵育器中孵育PBMC16-24小時,洗滌細胞,在4℃用小鼠抗-人CD28-PE和小鼠-抗-人CD69-APC抗體染色細胞,和通過流式細胞術測定CD28陽性細胞上的CD69表達。本文使用的術語“CD69”是指分化簇69,其是由CD69基因編碼的人跨膜C-型凝集素蛋白質。T淋巴細胞和天然殺傷(NK)細胞在體內和體外的活化,誘導CD69的表達。CD69用作參與細胞活化事件包括增殖的信號傳遞受體,用作在淋巴細胞包括天然殺傷細胞和血小板中的信號傳遞受體,和誘導特定基因。本文使用的術語“基于外周血單核細胞(PBMC)的功能測定法”是指用于評價本發明的抗體的功能特征,例如所述抗體影響T-細胞增殖或CD69表達的能力的測定法,其中存在的唯一細胞是外周血單核細胞。描述于實施例3、4、5和7的基于PBMC的功能測定法包括以下步驟:(i)用抗體在37℃在5%(vol/vol)CO2潮濕孵育器中孵育PBMC約16-24小時,(ii)洗滌細胞,(iii)在4℃用小鼠抗-人CD28-PE和小鼠-抗-人CD69-APC抗體染色細胞,和(iv)當評價CD69表達時,通過流式細胞術測定CD28陽性細胞上的CD69表達。因此,在一個實施方案中,CD69表達可按實施例3、4、5或7所述測定。因此,Fc區中在與C1q和FcGamma受體的相互作用中起主要作用的氨基酸可被修飾。可被修飾的氨基酸位置的實例包括位置L234、L235和P331。其組合,例如L234F/L235E/P331S,可引起與人CD64、CD32A、CD16和C1q結合的顯著降低。因此,在一個實施方案中,對應于L234、L235和P331的至少一個位置上的氨基酸可以分別是A、A和S([1]、[28])。此外,L234F和L235E氨基酸置換可產生具有與FcGamma受體和C1q的相互作用廢除的Fc區([29]-[30])。因此,在一個實施方案中,對應于L234和L235的位置上的氨基酸可以分別是F和E。D265A氨基酸置換可降低與所有Fcgamma受體的結合和防止ADCC([31])。因此,在一個實施方案中,對應于D265的位置上的氨基酸可以是A。與C1q的結合可通過突變位置D270、K322、P329和P331而廢除。突變這些位置成D270A或K322A或P329A或P331A任一個可使抗體缺乏CDC活性([32])。因此,在一個實施方案中,對應于D270、K322、P329和P331的至少一個位置上的氨基酸可以分別是A、A、A和A。使Fc區與Fcgamma受體和C1q相互作用最小化的備選方法為通過除去抗體的糖基化位點。突變位置N297為例如Q、A和E除去對于IgG-Fcgamma受體相互作用是關鍵的糖基化位點。因此,在一個實施方案中,對應于N297的位置上的氨基酸可以是G、Q、A或E([33])。使Fc區與Fcgamma受體的相互作用最小化的另一備選方法可以通過以下突變獲得:P238A、A327Q、P329A或E233P/L234V/L235A/G236del([31])。或者,盡管人IgG2和IgG4亞類被認為天然在它們與C1q和Fcgamma受體的相互作用中不足,但是仍有人報道了與Fcγ受體(Fcgamma受體)的相互作用([34]-[35])。廢除這些殘留相互作用的突變可在這兩個同種型中進行,導致與FcR結合有關的不需要的副作用減少。對于IgG2,這些包括L234A和G237A,和對于IgG4,包括L235E。因此,在一個實施方案中,人IgG2重鏈中對應于L234和G237的位置上的氨基酸可以分別是A和A。在一個實施方案中,人IgG4重鏈中對應于L235的位置上的氨基酸可以是E。在IgG2抗體中進一步使與Fcgamma受體和C1q相互作用最小化的其它方法包括描述于[36]和[37]中的那些。關于與Fcgamma受體和補體的相互作用,抗體的鉸鏈區也可能是重要的([38]-[39])。因此,鉸鏈區的突變或缺失可影響抗體的效應器功能。本文使用的術語“交聯”是指通過帶有FcR的細胞結合抗體Fc區的結合靶抗原的抗體Fab臂(單價或二價)的間接橋連。因此,在帶有靶抗原的細胞上結合其靶抗原的抗體可與表達FcR的另一細胞交聯。本文使用的術語“非特異性殺死”是指通過T細胞或其它效應細胞的細胞毒性功能,經過所述細胞的腫瘤靶抗原-非依賴性活化殺死細胞。因此,非特異性殺死意思是帶有腫瘤靶標的細胞可通過例如細胞毒性T細胞殺死,而不是通過結合腫瘤靶標的抗體通過例如誘導CDC而殺死。本發明人已經表明(見實施例3-5、7-10),非激活的Fc區可通過修飾Fc區的至少五個特定氨基酸位置中的一個或多個而獲得。因此,在一個實施方案中,抗體包含第一和第二免疫球蛋白重鏈,其中在所述第一和第二免疫球蛋白重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235、D265、N297和P331的位置上的一個或多個氨基酸分別不是L、L、D、N和P。在一個實施方案中,在第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234、L235、D265、N297和P331的位置上的一個或多個氨基酸分別不是L、L、D、N和P。在另一個實施方案中,在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的一個或多個氨基酸分別不是L、L和D,和對應于人IgG1重鏈的N297和P331的位置上的氨基酸分別是N和P。本文使用的術語“對應于位置的氨基酸”是指人IgG1重鏈的氨基酸位置編號。除非另外說明或上下文矛盾,恒定區序列的氨基酸在本文中根據Eu編號索引(描述于[27])編號。因此,一個序列中“對應于”另一個序列中的氨基酸或區段的氨基酸或區段是使用標準序列比對程序例如ALIGN、ClustalW或類似程序,通常以默認設置與其它氨基酸或區段比對,并與人IgG1重鏈具有至少50%、至少80%、至少90%或至少95%同一性的氨基酸或區段。本領域眾所周知的是,如何比對序列或序列中的區段和從而確定序列中與本發明的氨基酸位置相應的位置。在本發明的背景下,氨基酸可如上文所述定義。術語“氨基酸不是”或類似用語當涉及重鏈中的氨基酸時,應理解為意思是氨基酸是并非提及的特定氨基酸的任何其它氨基酸。例如,對應于人IgG1重鏈的L234的位置上的氨基酸不是L,意思是氨基酸可以是除了L之外的任何其它天然或非天然存在的氨基酸。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸不是D。在一個實施方案中,在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的D265的位置上的氨基酸不是D,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸是疏水的或極性的氨基酸。本文使用的關于氨基酸殘基的術語“疏水的”是指選自A、C、F、G、H、I、L、M、R、T、V、W和Y的氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自由A、C、F、G、H、I、L、M、R、T、V、W和Y組成的氨基酸。本文使用的關于氨基酸殘基的術語“極性的”是指選自C、D、E、H、K、N、Q、R、S和T的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人重鏈的位置D265的位置上的氨基酸選自C、E、H、K、N、Q、R、S和T。在另一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸是脂族不帶電荷、芳族或酸性氨基酸。本文使用的關于氨基酸殘基的術語“脂族不帶電荷”是指選自A、G、I、L和V的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、G、I、L和V。本文使用的關于氨基酸殘基的術語“芳族”是指選自F、T和W的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自F、T和W。本文使用的關于氨基酸殘基的術語“酸性”是指選自D和E的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自D和E。在具體的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、E、F、G、I、L、T、V和W。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸不是D。在一個實施方案中,在第一和第二重鏈兩者中,對應于人IgG1重鏈的D265的位置上的氨基酸不是D,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸是疏水的或極性的氨基酸。本文使用的關于氨基酸殘基的術語“疏水的”是指選自A、C、F、G、H、I、L、M、R、T、V、W和Y的氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自由A、C、F、G、H、I、L、M、R、T、V、W和Y組成的氨基酸。本文使用的關于氨基酸殘基的術語“極性的”是指選自C、D、E、H、K、N、Q、R、S和T的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人重鏈的位置D265的位置上的氨基酸選自C、E、H、K、N、Q、R、S和T。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自由A、C、F、G、H、I、L、M、R、T、V、W和Y組成的氨基酸。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人重鏈的位置D265的位置上的氨基酸選自C、E、H、K、N、Q、R、S和T。在另一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸是脂族不帶電荷、芳族或酸性氨基酸。本文使用的關于氨基酸殘基的術語“脂族不帶電荷”是指選自A、G、I、L和V的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、G、I、L和V。本文使用的關于氨基酸殘基的術語“芳族”是指選自F、T和W的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自F、T和W。本文使用的關于氨基酸殘基的術語“酸性”是指選自D和E的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自D和E。在具體的實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、E、F、G、I、L、T、V和W。在進一步的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置N297的位置上的氨基酸不是N。在一個實施方案中,在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的N297的位置上的氨基酸不是N,和對應于人IgG1重鏈的位置P331的位置上的氨基酸是P。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置N297的位置上的氨基酸不是N。在一個實施方案中,在第一和第二重鏈兩者中,對應于人IgG1重鏈的N297的位置上的氨基酸不是N,和對應于人IgG1重鏈的位置P331的位置上的氨基酸是P。在進一步的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別不是L和L。在一個實施方案中,在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的L234和L235的位置上的氨基酸分別不是L和L,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的氨基酸選自A、C、D、E、F、G、H、I、K、M、N、P、Q、R、S、T、Y、V。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸是疏水的或極性的氨基酸。本文使用的關于氨基酸殘基的術語“疏水的”是指選自A、C、F、G、H、I、L、M、R、T、V、W和Y的氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、F、G、H、I、M、R、T、V、W和Y。本文使用的關于氨基酸殘基的術語“極性”是指選自C、D、E、H、K、N、Q、R、S和T的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自由C、D、E、H、K、N、Q、R、S和T組成的氨基酸。在具體的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別不是L和L。在一個實施方案中,在第一和第二重鏈兩者中,對應于人IgG1重鏈的L234和L235的位置上的氨基酸分別不是L和L,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的L234和L235的位置上的氨基酸是疏水的或極性的氨基酸。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、F、G、H、I、M、R、T、V、W和Y。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自由C、D、E、H、K、N、Q、R、S和T組成的氨基酸。在具體的實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y。在另一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸是脂族不帶電荷、芳族或酸性氨基酸。本文使用的關于氨基酸殘基的術語“脂族不帶電荷”是指選自A、G、I、L和V的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、G、I和V。本文使用的關于氨基酸殘基的術語“芳族”是指選自F、T和W的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自F、T和W。本文使用的關于氨基酸殘基的術語“酸性”是指選自D和E的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自D和E。在具體的實施方案中,在所述第一和第二重鏈的至少一個中,對應于L234和L235的位置上的氨基酸各自選自A、D、E、F、G、I、T、V和W。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別是F和E;或A和A。在一個實施方案中,在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的L234和L235的位置上的氨基酸分別是F和E;或A和A,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別是F和E;或A和A。在一個實施方案中,在第一和第二重鏈兩者中,對應于人IgG1重鏈的L234和L235的位置上的氨基酸分別是F和E;或A和A,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在具體的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別是F和E。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別是F和E。在一個實施方案中,在所述第一和第二重鏈的至少一個中,至少對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別是A和A。在一個實施方案中,在所述第一和第二重鏈兩者中,至少對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸分別是A和A。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別不是L、L和D。在一個實施方案中,在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的L234、L235和D265的位置上的氨基酸分別不是L、L和D,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的氨基酸選自A、C、D、E、F、G、H、I、K、M、N、P、Q、R、S、T、Y、V和W,和對應于位置D265的氨基酸選自A、C、E、F、G、H、I、K、L、M、N、P、Q、R、S、T、Y、V和W。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸是疏水的或極性的氨基酸。本文使用的關于氨基酸殘基的術語“疏水的”是指選自A、C、F、G、H、I、L、M、R、T、V、W和Y的氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、C、F、G、H、I、L、M、R、T、V、W和Y,和對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、F、G、H、I、M、R、T、V、W和Y。本文使用的關于氨基酸殘基的術語“極性”是指選自C、D、E、H、K、N、Q、R、S和T的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自C、D、E、H、K、N、Q、R、S和T,對應于人重鏈的位置D265的位置上的氨基酸選自C、E、H、K、N、Q、R、S和T。在具體的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y,和對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、C、E、F、G、H、I、K、L、M、N、Q、R、S、T、V、W和Y。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的L234、L235和D265的位置上的氨基酸是疏水的或極性的氨基酸。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、C、F、G、H、I、L、M、R、T、V、W和Y,和對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、F、G、H、I、M、R、T、V、W和Y。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自C、D、E、H、K、N、Q、R、S和T,對應于人重鏈的位置D265的位置上的氨基酸選自C、E、H、K、N、Q、R、S和T。在具體的實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、C、D、E、F、G、H、I、K、M、N、Q、R、S、T、V、W和Y,和對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、C、E、F、G、H、I、K、L、M、N、Q、R、S、T、V、W和Y。在另一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸是脂族不帶電荷、芳族或酸性氨基酸。本文使用的關于氨基酸殘基的術語“脂族不帶電荷”是指選自A、G、I、L和V的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、G、I、L和V,和對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、G、I和V。本文使用的關于氨基酸殘基的術語“芳族”是指選自F、T和W的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸各自選自F、T和W。本文使用的關于氨基酸殘基的術語“酸性”是指選自D和E的任何氨基酸殘基。因此,在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸各自選自D和E。在具體的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、E、F、G、I、L、T、V和W,和對應于L234和L235的位置上的氨基酸各自選自A、D、E、F、G、I、T、V和W。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別不是L、L和D。在一個實施方案中,在第一和第二重鏈兩者中,對應于人IgG1重鏈的L234、L235和D265的位置上的氨基酸分別不是L、L和D,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的L234、L235和D265的位置上的氨基酸是脂族不帶電荷、芳族或酸性氨基酸。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、G、I、L和V,和對應于人IgG1重鏈的位置L234和L235的位置上的氨基酸各自選自A、G、I和V。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸各自選自D和E。在具體的實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置D265的位置上的氨基酸選自A、E、F、G、I、L、T、V和W,和對應于L234和L235的位置上的氨基酸各自選自A、D、E、F、G、I、T、V和W。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;或A、A和A。在一個實施方案中,在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的L234、L235和D265的位置上的氨基酸分別是F、E和A;或A、A和A,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;或A、A和A。在一個實施方案中,在第一和第二重鏈兩者中,對應于人IgG1重鏈的L234、L235和D265的位置上的氨基酸分別是F、E和A;或A、A和A,和對應于人IgG1重鏈的位置N297和P331的位置上的氨基酸分別是N和P。在具體的實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是A、A和A。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是A、A和A。在另一個實施方案中,在所述第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235、D265、N297和P331的位置上的氨基酸分別是F、E、A、Q和S。在一個實施方案中,在所述第一和第二重鏈兩者中,對應于人IgG1重鏈的位置L234、L235、D265、N297和P331的位置上的氨基酸分別是F、E、A、Q和S。在具體的實施方案中,本發明的抗體包含SEQIDNO:8所示的VH序列、SEQIDNO:10所示的VL序列,和在至少一個重鏈中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,本發明的抗體包含SEQIDNO:8所示的VH序列、SEQIDNO:12所示的VL序列,和在至少一個重鏈中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,本發明的抗體包含SEQIDNO:6所示的VH序列、SEQIDNO:10所示的VL序列,和在至少一個重鏈中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,本發明的抗體包含SEQIDNO:6所示的VH序列、SEQIDNO:12所示的VL序列,和在至少一個重鏈中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,本發明的抗體包含SEQIDNO:9所示的VH序列、SEQIDNO:10所示的VL序列,和在至少一個重鏈中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,本發明的抗體包含SEQIDNO:9所示的VH序列、SEQIDNO:12所示的VL序列,和在至少一個重鏈中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在一個方面,本發明的抗體包含SEQIDNO:31的人IgLC2/IgLC3恒定結構域λ輕鏈。在一個方面,本發明的抗體可在輕鏈(LC)和/或重鏈(HC)中被修飾以增加表達水平和/或生產收率。在一個實施方案中,本發明的抗體可在輕鏈(LC)中被修飾。這樣的修飾是本領域已知的,和可按照描述于例如Zheng,L.,Goddard,J.-P.,Baumann,U.,&Reymond,J.-L.(2004)Expressionimprovementandmechanisticstudyoftheretro-Diels-Alderasecatalyticantibody10F11bysite-directedmutagenesis.JournalofMolecularBiology,341(3),807–14.doi:10.1016/j.jmb.2004.06.014的方法進行。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置T41的位置上的氨基酸不是T。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置T41的位置上的氨基酸選自H、I、K、L、Q、R和V。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置T41的位置上的氨基酸是H、K或R,例如K。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置F10的位置上的氨基酸不是F,和其中對應于SEQIDNO:10的λ輕鏈的位置T41、K55和L97的氨基酸位置中的一個或多個分別不是T、K和L。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置F10、T41、K55和L97的位置上的氨基酸分別不是F、T、K和L。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于位置T41的位置上的氨基酸選自H、I、K、L、Q、R或V,例如選自H、K和R,例如K,和其中對應于SEQIDNO:10的λ輕鏈的位置F10、T41、K55和L97的位置上的氨基酸分別是L、K、N和H。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于位置R23和A35的位置上的氨基酸分別不是R和A。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于位置R23的位置上的氨基酸選自A、G、H、K、Q、S和T,例如選自A和G,和其中對應于A35的位置上的氨基酸選自I、L、M、P、V、G、F和W,例如選自I、L、M、P和V。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于位置R23的位置上的氨基酸是A或G,例如A,和對應于位置A35的位置上的氨基酸是P。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置F10、R23、A35、R47、D71、A82、D83、S86、I87和F89的位置上的氨基酸分別不是F、R、A、R、D、A、D、S、I和F。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于位置R23的位置上的氨基酸選自A、G、H、K、Q、S和T,例如選自A和G,其中對應于A35的位置上的氨基酸選自I、L、M、P、V、G、F和W,例如選自I、L、M、P,和其中對應于SEQIDNO:10的λ輕鏈的位置F10、R47、D71、A82、D83、S86、I87和F89的位置上的氨基酸分別是L、T、G、P、E、A、E和Y。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于位置R23的位置上的氨基酸是A或G,和其中對應于SEQIDNO:10的λ輕鏈的位置F10、A35、R47、D71、A82、D83、S86、I87和F89的位置上的氨基酸分別是L、P、T、G、P、E、A、E和Y。在一個方面,本發明的抗體可在輕鏈(LC)中被修飾以增加抗體的親和力。導致抗體親和力增加的修飾是本領域已知的。在一個方面,本發明的抗體可在輕鏈(LC)中被修飾以降低抗體的親和力。在某些情況下這可能是有利的,和導致功效增加。具體而言,低親和力的CD3臂可能對循環中和腫瘤位點的T細胞的活動力具有影響,從而導致腫瘤細胞更好地與T細胞的接合(engagement),參見M?lh?j等,MolecularImmunology44(2007)。具體而言,這可用于雙特異性形式,其中CD3抗體用作結合臂之一。導致抗體親和力降低的修飾是本領域已知的,參見例如Webster等IntJCancerSuppl.1988;3:13-6。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中(i)對應于SEQIDNO:10的λ輕鏈的位置F10的位置上的氨基酸不是F,或(ii)對應于SEQIDNO:10的λ輕鏈的位置K55的位置上的氨基酸不是K,或(iii)對應于SEQIDNO:10的λ輕鏈的位置F10的位置上的氨基酸不是F,和對應于SEQIDNO:10的λ輕鏈的位置K55的位置上的氨基酸不是K。在一個實施方案中,本發明的抗體包含恒定輕鏈(LC),其中(i)對應于SEQIDNO:10的λ輕鏈的位置F10的位置上的氨基酸是L,或者(ii)對應于SEQIDNO:10的λ輕鏈的位置K55的位置上的氨基酸是N,或者(iii)對應于SEQIDNO:10的λ輕鏈的位置F10的位置上的氨基酸是L,和對應于SEQIDNO:10的λ輕鏈的位置K55的位置上的氨基酸是N。在一個實施方案中,本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置F10、T41、K55和L97的位置上的氨基酸分別不是F、T、K和L。這樣的修飾用于增加表達水平和降低親和力兩者。本發明的抗體包含輕鏈(LC),其中對應于SEQIDNO:10的λ輕鏈的位置F10、T41、K55和L97的位置上的氨基酸分別是L、K、N和H。這樣的修飾用于增加表達水平和降低親和力兩者。在一個實施方案中,本發明的抗體包含重鏈(HC)和輕鏈(LC),其中對應于SEQIDNO:15的人IgG1重鏈的位置L234、L235和D265的位置分別是F、E和A,和其中對應于SEQIDNO:15的人IgG1重鏈的F405的位置是L,和其中(i)對應于SEQIDNO:10的λ輕鏈的位置F10、T41、K55和L97的位置分別是L、K、N和H,或(ii)對應于SEQIDNO:10的λ輕鏈的位置T41的位置是K。在一個實施方案中,本發明的抗體包含SEQIDNO:25的重鏈(HC)和SEQIDNO:32的輕鏈(LC)。在一個實施方案中,本發明的抗體包含SEQIDNO:25的重鏈(HC)和SEQIDNO:33的輕鏈(LC)。在一個方面,本發明涉及多特異性抗體,其至少包含本文所述的任何方面或實施方案的抗體的第一結合區,和與第一結合區結合一個或多個不同的靶標的一個或多個結合區。這樣的多特異性抗體可以是雙特異性抗體。因此,在一個方面,本發明涉及雙特異性抗體,其包含本文所述的任何方面或實施方案的抗體的第一結合區,和與第一結合區結合不同的靶標的第二結合區。術語“多特異性抗體”是指對至少兩個不同的例如至少三個、通常不重疊的表位具有特異性的抗體。這樣的表位可在相同或不同的靶標上。如果表位在不同的靶標上,這樣的靶標可在相同的細胞或不同的細胞或細胞類型上。術語“雙特異性抗體”是指對至少兩個不同的、通常不重疊的表位具有特異性的抗體。這樣的表位可在相同的或不同的靶標上。如果表位在不同的靶標上,這樣的靶標可在相同的細胞或不同的細胞或細胞類型上。在一個實施方案中,雙特異性抗體包含第一和第二重鏈。涉及Fc區的修飾的實施方案和涉及特定氨基酸置換的實施方案預期是本發明的任何雙特異性抗體的一部分。因此,在一個實施方案中,第一和第二重鏈中的至少一個包含按本文所述任何實施方案(例如關于提供無活性Fc區而描述的那些)定義進行修飾的一個或多個氨基酸。在一個實施方案中,所述第一和第二重鏈兩者包含按本文所述任何實施方案(例如關于提供無活性Fc區而描述的那些)定義進行修飾的一個或多個氨基酸。因此,雙特異性抗體包含按照本文所述的任何方面或實施方案進行修飾的Fc區;或所述第一和第二重鏈中的至少一個包含按本文所述的任何方面或實施方案定義進行修飾的一個或多個氨基酸。因此,在一個實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,C1q與所述抗體的結合減少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q結合通過ELISA測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,C1q與所述抗體的結合減少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q結合通過ELISA測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,C1q與所述抗體的結合減少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q結合通過ELISA測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,C1q與所述抗體的結合減少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q結合通過ELISA測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,C1q與所述抗體的結合減少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q結合通過ELISA測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,C1q與所述抗體的結合減少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中C1q結合通過ELISA測定。在另一個實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體介導Fc-介導的T-細胞增殖減少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T-細胞增殖用基于外周血單核細胞(PBMC)的功能測定法測量。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體介導Fc-介導的T-細胞增殖減少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T-細胞增殖用基于外周血單核細胞(PBMC)的功能測定法測量。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體介導Fc-介導的T-細胞增殖減少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T-細胞增殖用基于外周血單核細胞(PBMC)的功能測定法測量。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體介導Fc-介導的T-細胞增殖減少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T-細胞增殖用基于外周血單核細胞(PBMC)的功能測定法測量。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體介導Fc-介導的T-細胞增殖減少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T-細胞增殖用基于外周血單核細胞(PBMC)的功能測定法測量。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體介導Fc-介導的T-細胞增殖減少至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述T-細胞增殖用基于外周血單核細胞(PBMC)的功能測定法測量。在另一個實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體減少Fc-介導的CD69表達至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc-介導的CD69表達用基于PBMC的功能測定法測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體減少Fc-介導的CD69表達至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc-介導的CD69表達用基于PBMC的功能測定法測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體減少Fc-介導的CD69表達至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc-介導的CD69表達用基于PBMC的功能測定法測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體減少Fc-介導的CD69表達至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc-介導的CD69表達用基于PBMC的功能測定法測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體減少Fc-介導的CD69表達至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc-介導的CD69表達用基于PBMC的功能測定法測定。在一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中Fc區已被修飾,使得與野生型抗體相比,所述抗體減少Fc-介導的CD69表達至少50%、至少60%、至少70%、至少80%、至少90%、至少99%或100%,其中所述Fc-介導的CD69表達用基于PBMC的功能測定法測定。在具體的實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,雙特異性抗體包含包含SEQIDNO:8所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,雙特異性抗體包含包含SEQIDNO:6所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:10所示的VL序列的第一結合區;和其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在另一個實施方案中,雙特異性抗體包含包含SEQIDNO:9所示的VH序列和SEQIDNO:12所示的VL序列的第一結合區;和其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。可用于本發明的雙特異性抗體分子的實例包括(i)具有包含不同的抗原結合區的兩個臂的單一抗體,(ii)對兩個不同的表位具有特異性的單鏈抗體,例如經過由額外的肽接頭串聯的兩個scFv;(iii)雙重可變結構域抗體(DVD-IgTM),其中各輕鏈和重鏈包含通過短的肽連鍵串聯的兩個可變結構域([40]);(iv)化學連接的雙特異性(Fab’)2片段;(v)TandAb?,其是兩個單鏈雙抗體的融合物,產生四價雙特異性抗體,其對每個靶抗原具有兩個結合位點;(vi)柔韌抗體(flexibody),其是scFv與雙抗體的組合,產生多價分子;(vii)所謂的“停靠和鎖閉”分子(Dock-and-Lock?),根據蛋白質激酶A中的“二聚化和對接結構域”,當應用于Fab時,其可產生三價雙特異性結合蛋白,其由與不同的Fab片段連接的兩個相同的Fab片段組成;(viii)所謂的Scorpion分子,其包含例如與人Fab臂的兩個末端融合的兩個scFv;和(ix)雙抗體。在一個實施方案中,本發明的雙特異性抗體是雙抗體、雜合體(cross-body)或經過受控的Fab臂交換獲得的雙特異性抗體,例如DuoBody?(例如描述于[41]),如本發明中描述的那些。不同類型的雙特異性抗體的實例包括但不限于(i)IgG-樣分子,具有互補CH3結構域以強迫異源二聚化;(ii)重組的IgG-樣雙重靶向分子,其中分子的兩側各自包含至少兩種不同的抗體的Fab片段或Fab片段的一部分;(iii)IgG融合分子,其中全長IgG抗體與額外的Fab片段或Fab片段的一部分融合;(iv)Fc融合分子,其中單鏈Fv分子或穩定的雙抗體與重鏈恒定結構域、Fc-區或其一部分融合;(v)Fab融合分子,其中不同的Fab-片段融合在一起,與重鏈恒定結構域、Fc-區或其一部分融合;和(vi)基于ScFv和雙抗體的和重鏈抗體(例如,結構域抗體、Nanobodies?),其中不同的單鏈Fv分子或不同的雙抗體或不同的重鏈抗體(例如結構域抗體,Nanobodies?)彼此融合,或與融合至重鏈恒定結構域、Fc-區或其一部分的另一蛋白質或載體分子融合。具有互補的CH3結構域分子的IgG-樣分子的實例包括但不限于Triomab?(TrionPharma/FreseniusBiotech,[42])、Knobs-into-Holes(Genentech,[43])、CrossMAbs(Roche,[44])和靜電配對(Amgen,[45]-[46];Chugai,[47];Oncomed,[48])、LUZ-Y(Genentech)、DIG體和PIG體(Pharmabcine)、鏈交換改造結構域體(SEED體)(EMDSerono,[49])、Biclonics(Merus)、FcΔAdp(Regeneron,[50])、雙特異性IgG1和IgG2(Pfizer/Rinat,[51])、Azymetric支架(Zymeworks/Merck,[52])、mAb-Fv(Xencor,[53])、二價雙特異性抗體(Roche)和DuoBody?分子(GenmabA/S,[41])。重組IgG-樣雙重靶向分子的實例包括但不限于雙重靶向(DT)-Ig(GSK/Domantis)、二合一抗體(Genentech)、交聯Mab(KarmanosCancerCenter)、mAb2(F-Star,[54])、ZybodiesTM(Zyngenia)、用共有輕鏈的方法(Crucell/Merus,[55])、κλBodies(NovImmune)和CovX-body?(CovX/Pfizer)。IgG融合分子的實例包括但不限于雙重可變結構域(DVD)-IgTM(Abbott,[56])、雙重結構域雙頭抗體(Unilever;SanofiAventis,[57])、IgG-樣雙特異性(ImClone/EliLilly)、Ts2Ab(MedImmune/AZ)和BsAb(Zymogenetics)、HERCULES(BiogenIdec,[58])、scFv融合物(Novartis)、scFv融合物(ChangzhouAdamBiotechInc,[59])和TvAb(Roche,[59],[60])。Fc融合分子的實例包括但不限于ScFv/Fc融合物(AcademicInstitution)、SCORPION(EmergentBioSolutions/Trubion,Zymogenetics/BMS)、雙重親和力再導向技術(Fc-DARTTM)(MacroGenics,[62],[63])和雙重(ScFv)2-Fab(NationalResearchCenterforAntibodyMedicine–China)。Fab融合雙特異性抗體的實例包括但不限于F(ab)2(Medarex/AMGEN)、雙重作用或Bis-Fab(Genentech)、Dock-and-Lock?(DNL)(ImmunoMedics)、二價雙特異性(Biotecnol)和Fab-Fv(UCB-Celltech)。基于ScFv-、雙抗體-的抗體和結構域抗體的實例包括但不限于雙特異性T細胞銜接物(BiTE?)(Micromet,TandemDiabody(Tandab)(Affimed)、雙重親和力再導向技術(DARTTM)(MacroGenics)、單鏈雙抗體(Academic)、TCR-樣抗體(AIT,ReceptorLogics)、人血清白蛋白ScFv融合物(Merrimack)和COMBODY(EpigenBiotech)、雙重靶向nanobodies?(Ablynx)、雙重靶向僅重鏈結構域抗體。還預期,滿足本文所述的測定條件的任何單特異性抗體可形成雙特異性抗體的基礎。即,其中結合區之一結合CD3的雙特異性抗體可源自在功能測定法中測試并滿足本文所述要求的任何單特異性CD3抗體。這樣的雙特異性抗體可通過描述于[41]的方法提供,其通過引用結合到本文中。因此,在具體的實施方案中,所述第一和第二重鏈各自至少包含鉸鏈區、CH2和CH3區,其中在所述第一重鏈中對應于選自人IgG1重鏈的T366、L368、K370、D399、F405、Y407和K409的位置的位置上的至少一個氨基酸被置換,和在所述第二重鏈中對應于選自人IgG1重鏈的T366、L368、K370、D399、F405、Y407和K409的位置的位置上的至少一個氨基酸被置換,和其中所述第一和所述第二重鏈未在相同的位置上被置換。在該情況下,術語“置換”是指特定氨基酸位置上的氨基酸被另一天然或非天然存在的氨基酸置換。因此,在對應于人IgG1重鏈中的位置的位置上“置換的”氨基酸意指在特定位置上的氨基酸不同于IgG1重鏈中天然存在的氨基酸。在一個實施方案中,在所述第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸不是K、L或M,和任選地對應于人IgG1重鏈的F405的位置上的氨基酸是F,和在所述第二重鏈中對應于人IgG1重鏈中選自T366、L368、K370、D399、F405和Y407的位置的至少一個位置上的氨基酸被置換。在一個實施方案中,在所述第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸不是K、L或M,和在所述第二重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸不是F和任選地對應于人IgG1重鏈的K409的位置上的氨基酸是K。在一個實施方案中,在所述第一重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸不是F、R和G,和在所述第二重鏈中對應于人IgG1重鏈的選自T366、L368、K370、D399、Y407和K409的位置的位置上的氨基酸被置換。在一個實施方案中,在所述第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸不是K、L或M,和對應于人IgG1重鏈的F405的位置上的氨基酸不是F。在進一步的實施方案中,在所述第一重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L,和在所述第二重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R,或反之亦然。因此,在一個實施方案中,在第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R,和在第二重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L。在進一步的實施方案中,本發明的人源化或嵌合CD3抗體在第一和第二重鏈的至少一個中包含上述實施方案中任一個所公開的一個或多個無活性置換,例如L234F、L235E和D265A;和對應于F405的位置上的氨基酸不是F。在一個實施方案中,本發明的人源化或嵌合CD3抗體在第一和第二重鏈的至少一個中包含上述實施方案中任一個所公開的一個或多個無活性置換,例如L234F、L235E和D265A;和K409位置上的另外的置換,例如K409R。具體而言,在一個實施方案中,本發明的人源化或嵌合CD3抗體在第一和第二重鏈兩者中包含上述實施方案中任一個所公開的一個或多個無活性置換,例如L234F、L235E和D265A;和F405位置上的置換,例如F405L。在一個實施方案中,本發明的人源化或嵌合CD3抗體在第一和第二重鏈兩者中包含上述實施方案中任一個所公開的一個或多個無活性置換,例如L234F、L235E和D265A;和K409位置上的另外的置換,例如K409R。這樣的抗體可用于產生雙特異性抗體。因此,在進一步的實施方案中,在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A,在第一重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R。在一個實施方案中,在第一和第二重鏈的至少一個中對應于人IgG1重鏈的L234、L235、D265、N297和P331的位置上的氨基酸分別是F、E、A、N和P,在第一重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R。在備選的實施方案中,在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A,在第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R,和在第二重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L。在一個實施方案中,在第一和第二重鏈的至少一個中對應于人IgG1重鏈的L234、L235、D265、N297和P331的位置上的氨基酸分別是F、E、A、N和P,在第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R,和在第二重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L。在另一個實施方案中,在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A,在第一重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R。在一個實施方案中,在第一和第二重鏈兩者中對應于人IgG1重鏈的L234、L235、D265、N297和P331的位置上的氨基酸分別是F、E、A、N和P,在第一重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R。在備選的實施方案中,在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A,在第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R,和在第二重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L。在一個實施方案中,在第一和第二重鏈兩者中對應于人IgG1重鏈的L234、L235、D265、N297和P331的位置上的氨基酸分別是F、E、A、N和P,在第一重鏈中對應于人IgG1重鏈的K409的位置上的氨基酸是R,和在第二重鏈中對應于人IgG1重鏈的F405的位置上的氨基酸是L。如本文所述,T細胞募集至特定靶細胞,例如癌癥或腫瘤細胞,提供殺死靶細胞的方法。本發明人已證明,在兩條重鏈中包含特定氨基酸置換L234F、L235E和D265A的雙特異性CD3xHER2抗體能夠誘導殺死AU565細胞,如實施例5所述。T細胞介導的殺死可通過第一結合區靶向CD3和第二結合區靶向另一靶標的雙特異性抗體獲得。因此,在一個實施方案中,第一結合區按照本文所述的對于人源化或嵌合CD3抗體的任何實施方案,和第二結合區與第一結合區結合不同的靶標。應理解,當抗體是雙特異性抗體時,抗體的至少一半,即抗體的重鏈和輕鏈對之一,是本文所述的人源化或嵌合抗體。因此,雙特異性抗體的一半是根據本發明的結合CD3的人源化或嵌合抗體和另一半可以是結合第二靶標的人源化、嵌合、完全非人或完全人抗體。因此,在一個實施方案中,抗體包含第一和第二重鏈、第一和第二輕鏈,其中所述第一重鏈和所述第一輕鏈是人源化或嵌合的,和通過二硫橋連接,形成第一結合區;和所述第二重鏈和輕鏈是完全人的,和通過二硫橋連接,形成第二結合區,其中所述第一結合區按照本文所述的任何方面或實施方案,和所述第二結合區結合不同靶標。在一個實施方案中,抗體包含第一和第二重鏈、第一和第二輕鏈,其中所述第一重鏈和所述第一輕鏈是人源化或嵌合的,和通過二硫橋連接,形成第一結合區;和所述第二重鏈和輕鏈是人源化或嵌合的,和通過二硫橋連接,形成第二結合區,其中所述第一結合區根據本文所述的方面或實施方案,和所述第二結合區與所述第一結合區結合不同的CD3表位。因此,在一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈的至少一個中,對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中,對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:8所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:6所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:10所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:19所示的VH序列,和SEQIDNO:20所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。在另一個實施方案中,雙特異性抗體包含:第一結合區,包含SEQIDNO:9所示的VH序列,和SEQIDNO:12所示的VL序列;第二結合區,包含SEQIDNO:29所示的VH序列,和SEQIDNO:30所示的VL序列;其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A;和其中在第一重鏈中對應于人IgG1重鏈的位置F405的位置上的氨基酸是L,和在第二重鏈中對應于人IgG1重鏈的位置K409的位置上的氨基酸是R。本文使用的術語“二硫橋”是指兩個半胱氨酸殘基之間的共價鍵,即所述相互作用也可稱為Cys-Cys相互作用。本文使用的術語“靶標”是指本發明的抗體的結合區結合的分子。當用于抗體結合的背景下時,該術語包括產生的抗體所針對的任何抗原。在一個具體的實施方案中,第一重鏈和第一輕鏈是人源化或嵌合的,和通過二硫橋連接,形成第一結合區;和第二重鏈和輕鏈是全人的和通過二硫橋連接,形成第二結合區,其中第一結合區按照本文所述的任何方面或實施方案,和第二結合區結合不同的靶標;和其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在一個具體的實施方案中,第一重鏈和第一輕鏈是人源化或嵌合的和通過二硫橋連接,形成第一結合區;和第二重鏈和輕鏈是全人的和通過二硫橋連接,形成第二結合區,其中第一結合區按照本文所述的任何方面或實施方案,和第二結合區與第一結合區結合不同的CD3表位;和其中在第一和第二重鏈的至少一個中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在一個具體的實施方案中,第一重鏈和第一輕鏈是人源化或嵌合的和通過二硫橋連接,形成第一結合區;和第二重鏈和輕鏈是全人的和通過二硫橋連接,形成第二結合區,其中第一結合區按照本文所述的任何方面或實施方案,和第二結合區結合不同的靶標;和其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在一個具體的實施方案中,第一重鏈和第一輕鏈是人源化或嵌合的和通過二硫橋連接,形成第一結合區;和第二重鏈和輕鏈是全人的和通過二硫橋連接,形成第二結合區,其中第一結合區按照本文所述的任何方面或實施方案,和第二結合區與第一結合區結合不同的CD3表位;和其中在第一和第二重鏈兩者中對應于人IgG1重鏈的位置L234、L235和D265的位置上的氨基酸分別是F、E和A。在一個方面,本發明的雙特異性抗體包含結合人HER2或人CD20的第二結合區。在一個實施方案中,本發明的雙特異性抗體包含結合人CD20的第二結合區。在一個實施方案中,第二結合區可源自全長單克隆CD20抗體,例如公開于WO2004035607(GenmabA/S)的抗體,包括奧法木單抗(2F2)、11B8和7D8;公開于WO2005103081(GenmabA/S)的抗體,包括2C6;AME-133;TRU-015;IMMU-106;奧瑞珠單抗(Gazyva?);托西莫單抗(Bexxar?);和利妥昔單抗(Rituxan?/MabThera?)。在一個實施方案中,第二結合區可源自全長單克隆CD20抗體,該抗體結合CD20上的表位,其不包含或需要位置170的氨基酸殘基丙氨酸或位置172的脯氨酸,但其包含或需要位置163的氨基酸殘基天冬酰胺和位置166的天冬酰胺。在一個實施方案中,本發明的雙特異性抗體包含結合人CD20的第二結合區,所述結合區包含:(i)SEQIDNO:34的VHCDR1區、SEQIDNO:35的VHCDR2區、SEQIDNO:36的VHCDR3區、SEQIDNO:37的VLCDR1區、DAS的VLCDR2區和SEQIDNO:38的VLCDR3區,(ii)SEQIDNO:41的VHCDR1區、SEQIDNO:42的VHCDR2區、SEQIDNO:43的VHCDR3區、SEQIDNO:44的VLCDR1區、DAS的VLCDR2區和SEQIDNO:45的VLCDR3區,(iii)SEQIDNO:48的VHCDR1區、SEQIDNO:49的VHCDR2區、SEQIDNO:50的VHCDR3區、SEQIDNO:51的VLCDR1區、DAS的VLCDR2區和SEQIDNO:52的VLCDR3區,或者(iv)SEQIDNO:55的VHCDR1區、SEQIDNO:56的VHCDR2區、SEQIDNO:57的VHCDR3區、SEQIDNO:58的VLCDR1區、DAS的VLCDR2區和SEQIDNO:59的VLCDR3區。在一個實施方案中,本發明的雙特異性抗體包含結合人CD20的第二結合區,所述結合區包含:(i)VH序列,其與SEQIDNO:29所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性,和VL序列,其與SEQIDNO:30所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性,(ii)VH序列,其與SEQIDNO:39所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性,和VL序列,其與SEQIDNO:40所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性,(iii)VH序列,其與SEQIDNO:46所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性,和VL序列,其與SEQIDNO:47所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性,或者(iv)VH序列,其與SEQIDNO:53所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性,和VL序列,其與SEQIDNO:54所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%氨基酸序列同一性。在一個實施方案中,本發明的雙特異性抗體包含結合人CD20的第二結合區,所述第二結合區包含:(i)SEQIDNO:29的VH序列,和SEQIDNO:30的VL序列,(ii)SEQIDNO:39的VH序列,和SEQIDNO:40的VL序列,(iii)SEQIDNO:46的VH序列,和SEQIDNO:47的VL序列,或者(iv)SEQIDNO:53的VH序列,和SEQIDNO:54的VL序列。核酸構建體、表達載體和宿主細胞在一個方面,本發明涉及編碼表1所示的一個或多個序列的核酸構建體。因此,本發明涉及編碼SEQIDNO:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25和26所示的任何一個序列的核酸構建體。在進一步的方面,本發明涉及編碼本發明的人源化或嵌合CD3抗體的序列的核酸構建體、包含本發明的核酸構建體的表達載體、包含所述表達載體的宿主細胞、和通過在產生和任選地收回所述抗體的合適的條件下培養所述宿主細胞產生所述抗體的方法。人源化CD3抗體亦稱為“huCD3”。在一個實施方案中,本發明提供表達載體,其包含(i)編碼本發明的人源化或嵌合抗體的重鏈序列的核酸序列,(ii)編碼本發明的人源化或嵌合抗體的輕鏈序列的核酸序列,或(iii)(i)和(ii)兩者。因此,表達載體包含本文所述的任何方面或實施方案的一個或多個核酸構建體或核酸序列。在一個實施方案中,本發明的表達載體包含編碼選自SEQIDNO:1,2,3,4和5以及序列GTN的重鏈和輕鏈CDR序列中的一個或多個的核酸序列。在一個實施方案中,本發明提供表達載體,其包含編碼選自SEQIDNO:6、7、8、9、10、11、12、19、20、27、28、29和30的一個或多個氨基酸序列或其任何組合的核酸序列。在另一個實施方案中,表達載體包含編碼SEQIDNO:3所示的VHCDR3氨基酸序列的核酸序列。在另一個實施方案中,表達載體包含編碼選自SEQIDNO:6、7、8、9、19、27和29的VH氨基酸序列的核酸序列。在另一個實施方案中,表達載體包含編碼選自SEQIDNO:10、11、12、20、28和30的VL氨基酸序列的核酸序列。在另一個實施方案中,表達載體包含編碼人抗體輕鏈、人抗體重鏈或兩者的恒定區的核酸序列。在另一個實施方案中,本發明提供表達載體,其包含編碼根據SEQIDNO:15、16、23、24、25和26的氨基酸序列的核酸序列。在具體的實施方案中,表達載體包含編碼一個或多個上述氨基酸序列的變體的核酸序列,所述變體具有至多25個氨基酸修飾,例如至多20個,例如至多15、14、13、12或11個氨基酸修飾,例如10、9、8、7、6、5、4、3、2或1個氨基酸修飾,例如缺失或插入,優選置換,例如保守或非保守置換,或與任何所述序列具有至少80%同一性,例如與任何上述氨基酸序列具有至少85%同一性或90%同一性或95%同一性,例如96%同一性或97%同一性或98%同一性或99%同一性。本發明還涉及不同于上述核酸序列但由于遺傳密碼的差異而編碼與本發明的抗體相同的氨基酸序列的核酸序列。例如,核酸序列可不同,但產生與本文所述的任何氨基酸序列相同的氨基酸序列。如何基于遺傳密碼鑒定這樣的另外的核酸序列是技術人員眾所周知的。在進一步的實施方案中,表達載體進一步包含編碼抗體(例如人抗體)的輕鏈、重鏈或輕鏈和重鏈兩者的恒定區的核酸序列。上文所述的這樣的表達載體可用于重組產生本發明的抗體。在本發明的背景下,表達載體可以是任何合適的載體,包括染色體、非染色體和合成的核酸載體(包含一組合適的表達控制元件的核酸序列)。這樣的載體的實例包括SV40的衍生物、細菌質粒、噬菌體DNA、桿狀病毒、酵母質粒、源自質粒和噬菌體DNA的組合的載體,和病毒核酸(RNA或DNA)載體。在一個實施方案中,人源化或嵌合CD3抗體-編碼核酸包含在裸DNA或RNA載體中,包括例如線性表達元件(如描述于例如[64])、致密核酸載體(如描述于例如[65]和/或[66])、質粒載體例如pBR322、pUC19/18或pUC118/119、"midge"最低大小的核酸載體(如描述于例如[67]),或作為沉淀的核酸載體構建體,例如CaPO4--沉淀的構建體(如描述于例如[68]、[69]、[70]和[71])。這樣的核酸載體和其用途是本領域眾所周知的(見例如[72]和[73])。在一個實施方案中,所述載體適合于在細菌細胞中表達人源化或嵌合CD3抗體。這樣的載體的實例包括表達載體,例如BlueScript(Stratagene)、pIN載體([74])、pET載體(Novagen,MadisonWI)等。表達載體可另外或備選地是適合于在酵母系統中表達的載體。可使用適合于在酵母系統中表達的任何載體。合適的載體包括,例如包含組成型或誘導型啟動子,例如α因子、醇氧化酶和PGH的載體(綜述于[75]和[76])。核酸構建體和/或載體可還包含編碼分泌/定位序列的核酸序列,其可將多肽(例如新生的多肽鏈)靶向胞質空間或細胞培養基中。這樣的序列是本領域已知的,和包括分泌前導序列或信號肽、細胞器靶向序列(例如核定位序列、ER保留信號、線粒體運輸序列、葉綠體運輸序列)、膜定位/錨序列(例如終止轉移序列、GPI錨序列)等,其是本領域眾所周知的。在本發明的表達載體中,人源化或嵌合CD3抗體-編碼核酸可包含或與任何合適的啟動子、增強子和其它表達促進元件締合。這樣的元件的實例包括強表達啟動子(例如人CMVIE啟動子/增強子以及RSV、SV40、SL3-3、MMTV和HIVLTR啟動子)、有效的多聚(A)終止序列、大腸桿菌中質粒產物的復制起點、作為選擇性標記的抗生素抗性基因和/或合適的克隆位點(例如,聚合接頭)。核酸構建體和/或載體還可包含與組成型啟動子相對的誘導型啟動子,例如CMVIE(技術人員將知道,這些術語實際上是在某些條件下基因表達程度的描述符)。在一個實施方案中,人源化或嵌合CD3抗體-編碼表達載體位于宿主細胞或宿主動物中,和/或通過病毒載體遞送至宿主細胞或宿主動物。這樣的表達載體可用于重組產生人源化或嵌合CD3抗體。在一個方面,本發明提供包含本發明的表達載體的宿主細胞。在一個方面,本文所述的任何方面或實施方案的人源化或嵌合CD3抗體通過使用產生抗體的重組真核、重組原核或重組微生物宿主細胞提供。因此,本發明提供重組真核、重組原核或重組微生物宿主細胞,其產生本文定義的人源化或嵌合CD3抗體或免疫球蛋白。宿主細胞的實例包括酵母、細菌和哺乳動物細胞,例如CHO或HEK-293細胞。例如,在一個實施方案中,宿主細胞包含穩定整合至細胞基因組的核酸序列,其包含編碼本文所述的人源化或嵌合CD3抗體的表達的序列。在另一個實施方案中,宿主細胞包含非整合的核酸序列,例如質粒、粘粒、噬菌粒或線性表達元件,其包含編碼本文所述的人源化或嵌合CD3抗體的表達的序列。本文使用的術語"重組宿主細胞"(或簡稱"宿主細胞")意指表達載體或核酸構建體或序列所引入的細胞。應理解,該術語不僅意指具體的受試細胞,而且指所述細胞的子代。因為在傳代時由突變或環境影響導致可存在某些修飾,所述子代事實上可能與親代細胞不同,但仍包括在本文使用的術語"宿主細胞"的范圍內。重組宿主細胞包括例如:真核宿主細胞,例如CHO細胞、HEK-293細胞、PER.C6、NS0細胞和淋巴細胞;和原核細胞,例如大腸桿菌;和其它真核宿主,例如植物細胞和真菌。在進一步的方面,本發明涉及用于產生本發明的人源化或嵌合CD3抗體的方法,所述方法包括以下步驟:a)培養上文所述的本發明的宿主細胞,和b)從培養基回收和/或純化本發明的抗體。在進一步的方面,編碼人源化或嵌合CD3抗體的序列的核苷酸序列進一步編碼第二部分,例如治療多肽。示例性的治療多肽在本文另外描述。在一個實施方案中,本發明涉及用于產生人源化或嵌合CD3抗體融合蛋白的方法,所述方法包括以下步驟:a)培養宿主細胞,所述宿主細胞包含包含所述核苷酸序列的表達載體,和b)從培養基回收和/或純化人源化或嵌合CD3抗體融合蛋白。組合物在一個方面,本發明提供包含本文所述的任何方面和實施方案的抗體或雙特異性抗體的組合物。在一個方面,本發明提供包含本文所述的任何一個方面和實施方案定義的抗體或雙特異性抗體和藥學上可接受的載體的藥物組合物。藥物組合物可按照常規技術,例如描述于[77]中的技術,用藥學上可接受的載體或稀釋劑以及任何其它已知的助劑和賦形劑配制。藥學上可接受的載體或稀釋劑以及任何其它已知的助劑和賦形劑應適合于本發明的人源化或嵌合抗體和選擇的給藥方式。藥物組合物的載體和其它組分的適合性根據不存在對選擇的本發明的化合物或藥物組合物對抗原結合所需要的生物性質的顯著的負面影響來確定(例如,小于實質的影響(10%或更小的相對抑制、5%或更小的相對抑制等))。本發明的藥物組合物還可包括稀釋劑、填充劑、鹽、緩沖劑、去垢劑(例如非離子去垢劑,例如Tween-20或Tween-80)、穩定劑(例如糖或無蛋白質氨基酸)、防腐劑、組織固定劑、增溶劑和/或適合于包括在藥物組合物中的其它材料。本發明的藥物組合物中的活性成分的實際劑量水平可改變,以獲得對具體患者、組合物和給藥方式有效實現需要的治療反應并對患者無毒的量的活性成分。選擇的劑量水平將取決于醫學領域眾所周知的各種藥代動力學因素,包括使用的本發明的特定組合物或其酰胺的活性、給藥途徑、給藥次數、使用的特定化合物的排泄速率、治療持續時間;與使用的特定組合物組合使用的其它藥物、化合物和/或材料;治療的患者的年齡、性別、體重、病況、一般健康和之前的病史等因素。藥物組合物可通過任何合適的途徑和方式給予。體內和體外給予本發明的人源化或嵌合抗體的合適途徑是本領域眾所周知的,和可由本領域普通技術人員選擇。在一個實施方案中,本發明的藥物組合物經胃腸外給予。本文使用的短語"胃腸外給予"和"經胃腸外給予"意指腸內和局部給藥以外的給藥方式,通常通過注射,和包括表皮、靜脈內、肌內、動脈內、鞘內、囊內、眶內、心內、皮內、腹膜內、腱內、經氣管、皮下、表皮下、關節內、囊下、蛛網膜下、脊柱內、顱內、胸內、硬膜外和胸骨內注射和輸注。在一個實施方案中,藥物組合物通過靜脈內或皮下注射或輸注給予。藥學上可接受的載體包括任何和所有合適的溶劑、分散介質、包衣料、抗細菌和抗真菌劑、等滲劑、抗氧化劑和吸收延遲劑等,其在生理上與本發明的人源化或嵌合抗體相容。可用于本發明的藥物組合物的合適的水性和非水性載體的實例包括水、鹽水、磷酸鹽緩沖鹽水、乙醇、葡萄糖、多元醇(例如甘油、丙二醇、聚乙二醇等),和其合適的混合物;植物油例如橄欖油、玉米油、花生油、棉籽油和芝麻油;羧甲基纖維素膠體溶液、黃蓍膠和可注射的有機酯例如油酸乙酯,和/或各種緩沖液。其它載體是制藥領域眾所周知的。藥學上可接受的載體包括無菌水溶液或分散液和用于臨時制備無菌可注射溶液或分散液的無菌粉劑。對于藥學活性物質,這樣的介質和試劑的使用是本領域已知的。除非任何常規介質或試劑與活性化合物不相容,預期其在本發明的藥物組合物中使用。當涉及“活性化合物”時,預期也涉及本發明的人源化或嵌合抗體。適當的流動性可例如,通過使用包衣材料,例如卵磷脂,在分散劑的情況下通過保持所需的粒度,和通過使用表面活性劑來保持。本發明的藥物組合物還可包含藥學上可接受的抗氧化劑,例如(1)水溶性抗氧化劑,例如抗壞血酸、鹽酸半胱氨酸、硫酸氫鈉、偏亞硫酸氫鈉、亞硫酸鈉等;(2)油溶性抗氧化劑,例如抗壞血酸棕櫚酸酯、丁羥基茴香醚(BHA)、丁羥基甲苯(BHT)、卵磷脂、沒食子酸丙酯、α-生育酚等;和(3)金屬螯合劑,例如檸檬酸、乙二胺四乙酸(EDTA)、山梨醇、酒石酸、磷酸等。本發明的藥物組合物還可在組合物中包含等滲劑,例如糖、多元醇,例如甘露醇、山梨醇、甘油或氯化鈉。本發明的藥物組合物還可包含適合于選擇的給藥途徑的一種或多種助劑,例如防腐劑、濕潤劑、乳化劑、分散劑、防腐劑或緩沖劑,其可提高藥物組合物的半壽期或功效。本發明的人源化或嵌合抗體可與保護化合物免于快速釋放的載體一起制備,例如控釋制劑,包括植入物、透皮貼劑和微囊化遞送系統。這樣的載體可包括明膠、單硬脂酸甘油酯、二硬脂酸甘油酯、生物可降解的生物相容性聚合物例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、膠原、聚原酸酯和單獨或與蠟一起的聚乳酸,或本領域眾所周知的其它材料。用于制備這樣的制劑的方法是本領域技術人員通常已知的(參見例如[78])。在一個實施方案中,本發明的人源化或嵌合抗體可經配制以確保適當的體內分布。用于胃腸外給予的藥學上可接受的載體包括無菌水溶液或分散液和用于臨時制備無菌可注射溶液或分散液的無菌粉劑。對于藥學活性物質,這樣的介質和試劑的使用是本領域已知的。除非任何常規介質或試劑與活性化合物不相容,預期其在本發明的藥物組合物中使用。其它活性或治療化合物也可摻入組合物中。注射用的藥物組合物在制備和貯存條件下通常必須是無菌的和穩定的。組合物可配制為溶液、微乳劑、脂質體或適合于高藥物濃度的其它有序結構。載體可以是水性或非水性溶劑或分散介質,包括例如水、乙醇、多元醇(例如甘油、丙二醇、聚乙二醇等),和其合適的混合物;植物油例如橄欖油,和可注射有機酯,例如油酸乙酯。合適的流動性可例如,通過使用包衣料例如卵磷脂,在分散劑的情況下通過保持所需的粒度和通過使用表面活性劑來保持。在許多情況下,優選在組合物中包括等滲劑,例如糖、多元醇例如甘油、甘露醇、山梨醇或氯化鈉。可注射組合物的延長吸收可通過在組合物中包括延遲吸收的試劑,例如單硬脂酸鹽和明膠來產生。無菌注射溶液可通過將需要量的活性化合物與按需要例如上文列舉的一種成分或成分的組合一起摻入合適溶劑中,接著無菌微量過濾來制備。一般而言,分散液通過將活性化合物摻入包含基礎分散基質和需要的其它成分例如上文列舉的那些的無菌溶媒來制備。在用于制備無菌注射溶液的無菌粉劑的情況下,制備方法的實例是真空干燥和冷凍干燥(凍干),其得到來自其之前無菌過濾溶液的活性成分加任何其它需要的成分的粉末。無菌注射溶液可通過將需要量的活性化合物與按需要上文列舉的一種成分或成分的組合一起摻入合適的溶劑中,接著無菌微量過濾來制備。一般而言,分散液通過將活性化合物摻入包含基礎分散介質和來自上文列舉的那些的需要的其它成分的無菌溶媒中來制備。在用于制備無菌注射溶液的無菌粉劑的情況下,制備方法的實例是真空干燥和冷凍干燥(凍干),其得到來自其之前無菌過濾溶液的活性成分加任何其它需要的成分的粉末。治療應用在另一方面,本發明涉及本文所述的任何方面或實施方案定義的本發明的人源化或嵌合抗體或藥物組合物,其用作藥物。在另一方面,本發明涉及本文所述的任何方面或實施方案定義的本發明的人源化或嵌合抗體或藥物組合物,其用于治療疾病。本發明的人源化或嵌合抗體或藥物組合物可用于治療其中需要細胞毒性T細胞的效應器機制的任何癌癥。例如,人源化或嵌合抗體可給予至例如體外或離體培養的細胞,或例如體內給予至人受試者,以治療或預防病癥例如癌癥、炎性或自身免疫性病癥。本文使用的術語“受試者”通常是對人源化或嵌合抗體或藥物組合物有反應的人。受試者可例如包括具有病癥的人患者,所述病癥可通過調節靶功能或通過直接或間接導致殺死細胞來糾正或改善。在另一方面,本發明提供用于治療或預防病癥例如癌癥的方法,其中T細胞的募集將有助于治療或預防,所述方法包括給予治療有效量的本發明的人源化或嵌合抗體或藥物組合物至有需要的受試者。該方法通常包括給予受試者有效治療或預防所述病癥的量的人源化或嵌合抗體。在一個具體的方面,本發明涉及治療癌癥的方法,包括給予本文所述的任何方面和實施方案中定義的本發明的人源化或嵌合抗體或藥物組合物至有需要的受試者。在另一方面,本發明涉及本文所述的任何方面或實施方案中定義的用途或方法,其中人源化或嵌合抗體是特異性結合CD3和癌癥-特異性靶標或在癌癥中過量表達或與癌癥有關的靶標兩者的雙特異性抗體,所述靶標例如HER2、CD19、EpCAM、EGFR、CD66e(或CEA、CEACAM5)、CD33、EphA2或MCSP(或HMW-MAA),和其中疾病是癌癥,例如乳腺癌、前列腺癌、非小細胞肺癌、膀胱癌、卵巢癌、胃癌、結腸直腸癌、食管癌和頭和頸的鱗狀細胞癌、宮頸癌、胰腺癌、睪丸癌、惡性黑素瘤、軟組織癌癥(例如滑膜肉瘤)、無痛或侵襲形式的B-細胞淋巴瘤、慢性淋巴性白血病或急性淋巴性白血病。人源化或嵌合抗體的有效劑量和劑量方案取決于待治療的疾病或病況,和可由本領域技術人員確定。本領域具有普通技能的醫生可容易地確定和處方需要的有效量的藥物組合物。例如,醫生可以低于為實現理想的治療效果而需要的水平開始藥物組合物中使用的人源化或嵌合抗體的劑量,和逐漸增加劑量,直到實現理想的效果。一般而言,本發明的組合物的合適的劑量為根據特定的劑量方案有效產生治療效果的最低劑量的人源化或嵌合抗體的量。這樣的有效劑量一般取決于上文所述的因素。例如,治療用途的"有效量"可通過其穩定疾病進展的能力來測量。化合物抑制癌癥的能力可例如在預測在人腫瘤中的功效的動物模型系統中評價。或者,組合物的這種性質可通過技術人員已知的體外測定法檢查人源化或嵌合抗體抑制細胞生長或誘導細胞毒性的能力來評價。治療有效量的治療化合物,即本發明的治療人源化或嵌合抗體或藥物組合物,可減少腫瘤大小,或以其它方式改善受試者的癥狀。本領域普通技術人員將能夠根據例如受試者的大小、受試者的癥狀的嚴重性和特定組合物或選擇的給藥途徑等因素確定這樣的量。本發明的人源化或嵌合抗體的治療有效量的示例性的非限制性范圍是約0.001-30mg/kg,例如約0.001-20mg/kg,例如約0.001-10mg/kg,例如約0.001-5mg/kg,例如約0.001-2mg/kg,例如約0.001-1mg/kg,例如約0.001,約0.01,約0.1,約1,約5,約8,約10,約12,約15,約18mg/kg。給藥可例如是靜脈內、肌內、腹膜內或皮下的,和例如給予至靶標位點附近。上述治療方法和用途中的劑量方案經調整以提供最佳需要的反應(例如,治療反應)。例如,可給予單次推注,可隨時間給予數次分開的劑量,或按治療情況的緊急性所指示的,可按比例減少或增加劑量。在一個實施方案中,在治療期間,例如在預定的時間點,監測治療功效。如果需要,藥物組合物的有效日劑量可在全天中以合適的時間間隔作為單獨給予的兩次、三次、四次、五次、六次或更多次的子劑量,任選地以單位劑量形式給予。在另一個實施方案中,人源化或嵌合抗體或藥物組合物經長時間例如超過24小時通過緩慢連續輸注給予,以使不需要的副作用最小化。盡管有可能單獨給予本發明的人源化或嵌合抗體,但優選作為上文所述的藥物組合物給予人源化或嵌合抗體。有效劑量的本發明的人源化或嵌合抗體也可使用一周一次、兩周一次或三周一次的給藥期給予。給藥期可限制為例如,8周、12周或直到確定臨床進展。或者,有效劑量的本發明的人源化或嵌合抗體可每隔一周、兩周或三周給予。在一個實施方案中,人源化或嵌合抗體可通過輸注,以通過mg/m2計算的每周一次劑量給予。這樣的劑量可例如基于上文提供的mg/kg劑量,根據以下得到:劑量(mg/kg)x70:1.8。這樣的給藥可重復例如1-8次,例如3-5次。給藥可通過連續輸注進行2-24小時的一段時間,例如2-12小時。在一個實施方案中,人源化或嵌合抗體可通過緩慢連續輸注給予一段長的時間,例如超過24小時,以減少毒性副作用。在一個實施方案中,當一周一次給予時,人源化或嵌合抗體可以作為固定劑量計算的每周一次劑量給予至多8次,例如4-6次。這樣的方案可按需要重復一次或多次,例如在6個月或12個月后。這樣的固定劑量可例如基于上文提供的mg/kg劑量,體重估計為70kg。劑量可通過在給予后通過例如獲取生物樣品和使用靶向本發明的人源化或嵌合抗體的結合區的抗個體基因型抗體,測量在血液中本發明的人源化或嵌合抗體的量來確定或調整。在一個實施方案中,人源化或嵌合抗體可通過維持療法給予,例如一周一次持續6個月或更多的一段時間。人源化或嵌合抗體也可預防性給予以減少發生癌癥的風險,延遲癌癥進展中的事件發生的開始,和/或當癌癥減輕時減少復發風險。為容易給予和劑量的均勻性,胃腸外組合物可配制為劑量單位形式。本文使用的劑量單位形式是指適合作為待治療的受試者的單一劑量的物理離散單位;每個單位包含經計算產生需要的治療效果的預定量的活性化合物和需要的藥用載體。本發明的劑量單位形式的規格通過以下方面來指示和直接取決于以下方面:(a)活性化合物的獨特特征和欲實現的特定治療效果,和(b)本領域中調配這樣的活性化合物用于治療個體的敏感性而固有的局限性。人源化或嵌合抗體也可預防性給予以減少發生癌癥的風險,延遲癌癥進展中的事件發生的開始,和/或當癌癥緩解時減少復發風險。在其中難以定位由于其它生物因素而已知存在的腫瘤的患者中,這可能是特別有用的。診斷應用使用包含本文所述的人源化或嵌合抗體的組合物,本發明的人源化或嵌合抗體還可用于診斷目的。因此,本發明提供使用本文所述的人源化或嵌合抗體的診斷方法和組合物。這樣的方法和組合物可用于純粹的診斷目的,例如檢測或鑒定疾病,以及用于監測治療性治療的進展,監測疾病進展,評價治療后的狀態,監測疾病的復發,評價發生疾病的風險等。在一個方面,本發明涉及診斷特征為涉及或積聚CD3-表達細胞的疾病的方法,包括給予本發明的人源化或嵌合抗體,本發明的組合物,或本發明的藥物組合物至受試者,任選地其中所述人源化或嵌合抗體用可檢測試劑標記。在一個方面,本發明的人源化或嵌合抗體離體使用,例如用于通過在獲自患者的樣品中檢測靶標的水平或在其細胞表面上表達目的靶標的細胞的水平,診斷其中表達特定目的靶標且被人源化或嵌合抗體結合的細胞指示疾病或涉及發病機理的疾病。這可例如通過使測試的樣品,任選地與對照樣品一起,在允許抗體與靶標結合的條件下接觸本發明的人源化或嵌合抗體來實現。然后可檢測復合物形成(例如使用ELISA)。當使用對照樣品連同測試樣品時,在兩種樣品中分析人源化或嵌合抗體或抗體-靶標復合物的水平,和測試樣品中統計學顯著的更高水平的人源化或嵌合抗體或抗體-靶標復合物指示與對照樣品相比,測試樣品中更高水平的靶標。其中可使用本發明的人源化或嵌合抗體的常規免疫測定的實例包括而不限于ELISA、RIA、FACS分析、等離子體共振分析、色譜分析、組織免疫組織化學、蛋白質印跡和/或免疫沉淀。因此,在一個實施方案中,本發明涉及診斷特征為涉及或積聚CD3-表達細胞的疾病的方法,包括給予本文所述的任何方面或實施方案的抗體、雙特異性抗體、組合物或藥物組合物至受試者,任選地其中抗體用可檢測標記進行標記。在一個實施方案中,本發明涉及用于檢測樣品中靶標或表達靶標的細胞的存在情況的方法,包括:-使樣品與本發明的人源化或嵌合抗體在允許人源化或嵌合抗體與樣品中的靶標結合的條件下接觸;和-分析是否形成復合物。通常,樣品是生物學樣品。在一個實施方案中,樣品是已知或疑似包含特定靶標和/或表達靶標的細胞的組織樣品。例如,原位檢測靶標表達可通過從患者移出組織學樣本,和提供本發明的人源化或嵌合抗體至這樣的樣本來實現。人源化或嵌合抗體可通過施加或涂覆人源化或嵌合抗體至樣本來提供,然后使用合適的工具對其進行檢測。然后可能不僅檢測靶標或表達靶標的細胞的存在情況,而且檢測靶標或表達靶標的細胞在受檢組織中的分布(例如,在評價癌細胞的擴散的情況下)。使用本發明,普通技術人員容易地理解,各種組織學方法中的任一種(例如染色程序)可被改良,以實現這樣的原位檢測。在上述測定法中,人源化或嵌合抗體可用可檢測物質進行標記,以允許結合的抗體被檢測。或者,結合的(第一)特異性人源化或嵌合抗體可通過用可檢測物質進行標記和結合第一特異性人源化或嵌合抗體的抗體檢測。此外,在上述測定法中,可使用包含本文所述的任何方面或實施方案的抗體或雙特異性抗體的診斷組合物。因此,在一個方面,本發明涉及包含本文所述的任何方面或實施方案的抗體或雙特異性抗體的診斷組合物。樣品中的靶標水平還可使用用可檢測物質標記的靶標標準物和未標記的靶標特異性的人源化或嵌合抗體,通過競爭免疫測定法進行評價。在該類型的測定法中,將生物樣品、標記的靶標標準物和靶標特異性人源化或嵌合抗體組合,和測定與未標記的靶標特異性人源化或嵌合抗體結合的標記的靶標標準物的量。生物樣品中靶標的量與結合至靶標特異性人源化或嵌合抗體的標記的靶標標準物的量成反比。用于體外診斷技術的靶標特異性人源化或嵌合抗體、第二抗體和/或靶標標準物的合適的標記包括而不限于各種酶、輔基、熒光材料、發光材料和放射性材料。合適的酶的實例包括辣根過氧化物酶、堿性磷酸酶、β-半乳糖苷酶和乙酰膽堿酯酶;合適的輔基復合物的實例包括鏈霉抗生物素/生物素和親和素/生物素;合適的熒光材料的實例包括傘形酮、熒光素、異硫氰酸熒光素、若丹明、二氯三嗪胺熒光素、丹酰氯和藻紅蛋白;發光材料的實例包括魯米諾;和合適放射性材料的實例包括125I、131I、35S和3H。在一個方面,本發明的靶標特異性人源化或嵌合抗體用于表達靶標的組織例如腫瘤的體內成像。對于體內方法,抗體片段例如(Fab’)2、Fab和Fab’片段,因為其快速分布動力學而是特別有利的。體內成像可通過任何合適的技術進行。例如,用99Tc、131I、111In或其它發射γ射線的同位素標記的靶標特異性人源化或嵌合抗體(例如抗體或片段)可用于在表達靶標的組織例如腫瘤中,用γ閃爍照相機(例如ElscintApex409ECT設備),通常使用低能高分辨率準直儀或低能通用準直儀成像靶標特異性抗體積聚或分布。或者,用89Zr、76Br、18F或其它發射正電子的放射性核素標記可在腫瘤中使用正電子發射斷層照相術(PET),用于成像靶標特異性人源化或嵌合抗體或抗體片段分布。通過使用這樣的技術獲得的圖像可用于評價在患者、哺乳動物或組織中的靶標的生物分布,例如在使用靶標作為癌癥/腫瘤細胞的存在情況的生物標記物的情況下。該技術的變化可包括使用磁共振成像(MRI)以改進經γ照相機技術的成像。常規的免疫閃爍成像方法和原理描述于例如[79]、[80]和[81]。此外,這樣的圖像也可或備選地用作除去腫瘤的手術技術的基礎。此外,這樣的體內成像技術可在其中患者被鑒定為具有腫瘤(由于存在其它生物標記物、轉移等)但腫瘤不能通過傳統分析技術鑒定的情況下,允許鑒定和定位腫瘤。所有這些方法是本發明的特征。本發明提供的體內成像和其它診斷方法可特別用于檢測人患者(例如,之前未診斷患有癌癥的患者或處于癌癥恢復/緩解期的患者)中的微小轉移。在一個實施方案中,本發明提供體內成像方法,其中本發明的靶標特異性人源化或嵌合抗體與促進檢測的不透射線的試劑綴合,綴合的人源化或嵌合抗體給予至宿主,例如通過注射至血流,和分析標記的人源化或嵌合抗體在宿主中的存在情況和位置。通過本文提供的該技術和任何其它診斷方法,本發明提供用于篩選在人患者或獲自人患者的生物樣品中疾病相關細胞的存在情況的方法和/或用于在靶標特異性ADC療法之前評價靶標特異性人源化或嵌合抗體的分布的方法。對于診斷成像,放射性同位素可與靶標特異性人源化或嵌合抗體直接或通過使用中間官能團間接結合。有用的中間官能團包括螯合劑,例如乙二胺四乙酸和二亞乙基三胺五乙酸(參見例如[82])。除了放射性同位素和不透射線的試劑之外,診斷方法可使用與染料(例如與生物素-鏈霉抗生物素復合物)、造影劑、熒光化合物或分子和用于磁共振成像(MRI)的增強劑(例如順磁離子)綴合的靶標特異性抗體進行(參見例如[83],其描述了MRI技術和與MRI增強劑綴合的抗體的制備)。這樣的診斷/檢測試劑可選自用于MRI的試劑和熒光化合物。為了用放射性金屬或順磁離子加載靶標特異性人源化或嵌合抗體,可能有必要將其與具有長尾的試劑反應,多倍螯合基團與所述長尾連接以結合離子。這樣的尾可以是聚合物例如聚賴氨酸、聚糖或具有側掛基團的另一衍生化或衍生的鏈,螯合基團可與所述側掛基團結合,例如已知用于該目的的卟啉、聚胺、冠醚、雙硫代半卡巴腙、聚肟等基團。螯合劑可使用標準化學與靶標特異性人源化或嵌合抗體偶聯。因此,本發明提供診斷性靶標特異性人源化或嵌合抗體,其中靶標特異性人源化或嵌合抗體與造影劑(例如用于磁共振成像、計算機斷層照相術或超聲對比增強劑)或放射性核素(其可以是例如γ-、β-、α-、Auger電子-或正電子-發射型同位素)綴合。在一個方面,本發明涉及包含本發明的抗體或雙特異性抗體的診斷組合物。在進一步的方面,本發明涉及用于檢測樣品中靶標抗原或表達靶標的細胞的存在情況的試劑盒,包含:-本發明的靶標特異性人源化或嵌合抗體;和-試劑盒的使用說明書。因此,在一個方面,本發明提供用于檢測樣品中CD3抗原或表達CD3的細胞的存在情況的試劑盒,包括以下步驟:a)使樣品與本發明的抗體或雙特異性抗體在允許在抗體或雙特異性抗體和CD3之間形成復合物的條件下接觸;和b)分析是否形成復合物。在一個實施方案中,本發明提供用于診斷癌癥的試劑盒,其包含包含靶標特異性人源化或嵌合抗體的容器,和用于檢測靶標特異性人源化或嵌合抗體與靶標結合的一種或多種試劑。試劑可包括例如熒光標簽、酶標簽或其它可檢測標簽。試劑還可包括第二或第三抗體或用于酶反應的試劑,其中酶反應產生可被顯現的產物。在一個實施方案中,本發明提供診斷試劑盒,其包含在合適的容器中的呈標記或未標記形式的本發明的一種或多種靶標特異性人源化或嵌合抗體、用于間接測定法孵育的試劑,和用于在這樣的測定法中檢測的底物或衍生試劑(取決于標簽的性質)。還可包括對照試劑和使用說明書。還可提供與靶標特異性人源化或嵌合抗體、例如標記的靶標特異性抗體使用的診斷試劑盒,用于檢測組織樣品或宿主中靶標的存在情況。在這樣的診斷試劑盒中以及在本文他處描述的治療用途的試劑盒中,靶標特異性人源化或嵌合抗體通常可以凍干形式在容器中單獨或與對靶細胞或肽有特異性的另外的抗體結合提供。通常,還可包括藥學上可接受的載體(例如,惰性稀釋劑)和/或其組分,例如Tris、磷酸鹽或碳酸鹽緩沖液、穩定劑、防腐劑、殺生物劑、惰性蛋白例如血清白蛋白等(通常在分開的容器中用于混合)和另外的試劑(也通常在分開的容器中)。在某些試劑盒中,還包括能夠結合靶標特異性人源化或嵌合抗體的第二抗體,其通常存在于單獨的容器中。第二抗體通常與標簽綴合和以類似于本發明的靶標特異性人源化或嵌合抗體的方式配制。使用上文和本文他處描述的方法,靶標特異性人源化或嵌合抗體可用于定義癌癥/腫瘤細胞的子集和表征這樣的細胞和相關腫瘤組織。抗個體基因型抗體在進一步的方面,本發明涉及抗個體基因型抗體,其結合本文所述的本發明的人源化或嵌合抗體。抗個體基因型(Id)抗體是識別通常與抗體的抗原結合位點關聯的獨特的決定簇的抗體。抗-Id抗體可通過用對其制備了抗-Id的單克隆抗體免疫與CD3單克隆抗體的來源相同的物種和基因型的動物制備。免疫的動物通常可通過產生對這些個體基因型決定簇的抗體(抗-Id抗體)而識別和響應免疫抗體的個體基因型決定簇。這樣的抗體描述于例如US4,699,880。這樣的抗體是本發明的另外特征。抗-Id抗體也可用作"免疫原"以在又一動物中誘導免疫反應,產生所謂的抗-抗-Id抗體。抗-抗-Id抗體可在表位上與誘導抗-Id抗體的原始單克隆抗體相同。因此,通過使用針對單克隆抗體的個體基因型決定簇的抗體,有可能鑒定表達相同特異性的抗體的其它克隆。通過任何合適的技術,例如本文他處關于本發明的CD3-特異性抗體描述的那些技術,抗-Id抗體可以改變(從而產生抗-Id抗體變體)和/或衍生。例如,單克隆抗-Id抗體可與載體例如匙孔血藍蛋白(KLH)偶聯和用于免疫BALB/c小鼠。來自這些小鼠的血清通常包含抗-抗-Id抗體,其具有類似于(如果不相同)原始/親代CD3抗體的結合性質。序列表1CDR區根據IMGT定義注釋。實施例實施例1–人源化CD3抗體和非-激活的抗體變體的產生CD3抗體的人源化鼠CD3抗體(US8,236,308,本文描述為IgG1-CD3)的人源化通過Antitope(Cambridge,UK)使用其改進形式的種系人源化(CDR-移植)技術(EP0629240)進行。使用該技術,設計4個不同的VH鏈(SEQIDNO:6、7、8和9)和3個不同的VL鏈(SEQIDNO:10、11和12)。通過組合這些4個VH與3個VL鏈,產生12種不同的抗體。人源化變體在本文描述為huCD3。因此,本發明的包含VH和VL的人源化變體被描述為例如,IgG1-huCD3-H1L1,其意指所述特定變體具有IgG1同種型,是人源化CD3和包含稱為“H1”和根據SEQIDNO:6定義的VH氨基酸序列和稱為“L1”和根據SEQIDNO:10定義的VL氨基酸序列。因此,H1是指可變重鏈區VH1,L1是指可變輕鏈區VL1,等等。具體而言,產生變體IgG1-huCD3-H1L1(包含SEQIDNO:6所示的VH1序列和SEQIDNO:10所示的VL1序列的人源化CD3)、IgG1-huCD3-H1L2(包含SEQIDNO:6所示的VH1序列和SEQIDNO:11所示的VL2序列的人源化CD3)、IgG1-huCD3-H1L3(包含SEQIDNO:6所示的VH1序列和SEQIDNO:12所示的VL3序列的人源化CD3)、IgG1-huCD3-H3L3(包含SEQIDNO:8所示的VH3序列和SEQIDNO:12所示的VL3序列的人源化CD3)、IgG1-huCD3-H4L1(包含SEQIDNO:9所示的VH4序列和SEQIDNO:10所示的VL1序列的人源化CD3)、IgG1-huCD3-H3L1(包含SEQIDNO:8所示的VH3序列和SEQIDNO:10所示的VL1序列的人源化CD3)、IgG1-huCD3-H3L3(包含SEQIDNO:8所示的VH3序列和SEQIDNO:12所示的VL3序列的人源化CD3)和IgG1-huCD3-H4L3(包含SEQIDNO:9所示的VH4序列和SEQIDNO:12所示的VL3序列的人源化CD3),并在本文所述的實施例中測試。在一些實施例中,包含huCLB-T3/4的重鏈和輕鏈可變區序列(分別為SEQIDNO:17和18)的抗體用作對照抗體(Labrijn等,PNAS2013,110:5145-50)和驗證Fc區中的不同的非-激活的突變組合(見實施例8-10)。huCBL-T3/4是人源化形式的鼠CD3抗體CLB-T3/4(Parren等,ResImmunol.1991,142(9):749-63)。將兩個序列(SEQIDNO:17和18)克隆至相關的pcDNA3.3(Invitrogen)表達載體和通過共轉染在HEK293F細胞中表達。得到的對照抗體描述為IgG1-huCLB-T3/4。在一些實施例中,包含CD20抗體7D8的重鏈和輕鏈可變區序列(SEQIDNO:29對應于VH序列和SEQIDNO:30對應于VL序列)的抗體用作陽性對照。當在陽性對照的情況下使用時,其稱為“IgG1-CD20”。這些IgG1-CD3(即嵌合的親本CD3抗體)、IgG1-huCD3和IgG1-huCLB-T3/4抗體以單特異性和雙特異性形式使用,其中雙特異性抗體按下文所述產生。HER2抗體在一些實施例中,使用針對HER2的抗體。用于該HER2-特異性抗體的VH和VL序列(抗體169,分別為SEQIDNO:19和20)在之前描述(WO2012/143524[Genmab];Labrijn等,PNAS2013,110:5145-50)。該抗體以單特異性和雙特異性形式兩者使用,和被稱為“IgG1-HER2”。b12抗體在一些實施例中,抗體b12,一種gp120特異性抗體(Barbas,CF.JMolBiol.1993Apr5;230(3):812-23.)用作陰性對照,和被稱為“IgG1-b12”。表達抗體作為IgG1,κ或IgG1,λ表達,帶有或沒有下文描述的非-激活的突變和具有通過下文描述的方法能夠產生雙特異性抗體的CH3結構域中的突變:IgG1-HER2-K409R、IgG1-b12-K409R、IgG1-CD3-F405L。基本上按制造商所述,使用293fectin(Invitrogen,US),將編碼抗體的重鏈和輕鏈兩者的質粒DNA混合物瞬時轉染至FreestyleHEK293F細胞(Invitrogen,US)。抗體的純化培養上清液通過加載到5mLMabSelectSuRe柱(GEHealthCare)的0.2μm空端過濾器過濾和用0.1M檸檬酸鈉-NaOH,pH3洗脫。洗脫液立即用2MTris-HCl,pH9中和,和過夜透析至12.6mMNaH2PO4,140mMNaCl,pH7.4(B.Braun)。或者,純化后,將洗脫液加載至HiPrep脫鹽柱和將抗體交換至12.6mMNaH2PO4,140mMNaCl,pH7.4(B.Braun)緩沖液。在透析或緩沖液交換后,將樣品經0.2μm空端過濾器無菌過濾。通過SDS-PAGE測定純度,和通過280nm的吸光度測量濃度。純化的抗體在2-8℃下貯存。雙特異性抗體的產生使用DuoBody?平臺技術,即2-MEA-誘導的Fab-臂交換,如WO2011/147986和Labrijn等(Labrijn等,PNAS2013,110:5145-50;Gramer等,MAbs2013,5:962-973)中所描述,體外產生雙特異性抗體。為了能夠通過該方法產生雙特異性抗體,產生在CH3結構域中帶有單一突變的IgG1分子:在一種親本IgG1抗體中F405L突變(即IgG1-CD3抗體),在其它親本IgG1抗體中K409R突變(即HER2或b12抗體)。為了產生雙特異性抗體,這兩種親本抗體,各抗體終濃度為0.5mg/mL,用25或75mM2-巰基乙胺-HCl(2-MEA)在總體積500μLTE中在31℃孵育5小時。當通過使用用25mLPBS平衡的PD-10柱(GE-healthcare,product#17-0851-01)將還原劑2-MEA除去時,終止還原反應。脫鹽前,加入2mLPBS(B.Braun,產品號3623140)至樣品,以調整體積至2.5mL。在3.5mLPBS中進行洗脫。在AmiconUltra離心設備(30kDMWCO,Millipore,產品號UFC803096)中收集樣品和通過以3000xg離心8min濃縮。用PBS調整體積至500μL(當需要時)和樣品通過0.2μm過濾器(Millex-GV,產品號SLGV004SL)無菌過濾。雙特異性產物在2-8℃下貯存。在得到相同的雙特異性抗體的備選方式中,為了產生雙特異性抗體,將100μg的兩種親本抗體混合,和用75mM2-巰基乙胺-HCl(2-MEA)在總體積400μLPBS(B.Braun,產品號3623140)中在31℃孵育5小時。當通過使用AmiconUltra0.5ml離心設備(10kDMWCO,Millipore,產品號UFC501096)和用400μlPBS通過以13000xg離心10min洗滌4次來除去還原劑2-MEA時,終止還原反應。通過倒置過濾器和以1000g離心2min在新管中收集樣品。用PBS調整體積至200μL(當需要時)。測量雙特異性產物的280nm的吸光度(A280),以確定終濃度。進行HPLC陽離子交換色譜(HPLC-CEX)(描述于WO2013/060867),以確定雙特異性產物的量。樣品在2-8℃下貯存。產生的雙特異性抗體在下文中描述為“K409RIgG1骨架”和“F405LIgG1骨架”。非-激活的突變用Fc區中的一個或多個氨基酸置換產生幾種抗體變體。非-激活的Fc區阻止抗體與血細胞(例如單核細胞)上存在的Fc-受體相互作用,或阻止抗體與C1q相互作用以激活經典補體途徑。在包含Fc區的氨基酸置換的不同組合的抗體變體中測試Fc活性的降低。引入最多5個氨基酸置換,其包括突變N297Q、L234A、L235A、L234F、L235E、D265A和P331S。在這5個氨基酸位置的一個或多個中的置換被引入K409R和/或F405LIgG1骨架。產生huCLB-T3/4抗體的以下的Fc區變體:N297Q(是指N297Q置換,稱為IgG1-huCLB-T3/4-N297Q)、LFLE(是指L234F/L235E置換,稱為IgG1-huCLB-T3/4-LFLE)、LALA(是指L234A/L235A置換,稱為IgG1-huCLB-T3/4-LALA)、LFLENQ(是指L234F/L235E/N297Q置換,稱為IgG1-huCLB-T3/4-LFLENQ)、LFLEDA(是指L234F/L235E/D265A置換,稱為IgG1-huCLB-T3/4-LFLEDA)、DA(是指D265A置換,稱為IgG1-huCLB-T3/4-DA)、DAPS(是指D265A/P331S置換,稱為IgG1-huCLB-T3/4-DAPS)、DANQ(是指D265A/N297Q置換,稱為IgG1-huCLB-T3/4-DANQ)、LFLEPS(是指L234F/L235E/P331S置換,稱為IgG1-huCLB-T3/4-LFLEPS)和LFLEDANQPS(是指L234F/L235E/D265A/N297Q/P331S置換,稱為IgG1-huCLB-T3/4-LFLEDANQPS)。具體而言,在IgG1-huCD3抗體變體中,3個氨基酸置換的組合,其包括突變L234F、L235E和D265A和稱為LFLEDA,引入K409R和F405LIgG1骨架中,以產生具有非-激活的Fc區的抗體。得到的非-激活的抗體變體以后綴“-LFLEDA”命名。實施例2-人源化CD3抗體和其非-激活的變體與表達CD3的人和食蟹猴T細胞系結合人源化CD3(huCD3)抗體的純化的變體和雙特異性(bs)IgG1-huCD3xHER2分子(見實施例1),帶有或沒有Fc區的LFLEDA突變,與人T細胞系Jurkat(CloneE6-1,ATCC?TIB-152?,LGCStandardsGmbH,Wesel,Germany)或食蟹猴T細胞系HSC-F(cat.no.JCRB1164;HealthScienceResearchResourcesBank,Osaka,Japan)的結合通過FACS分析進行分析。除了非-激活的突變LFLEDA之外,抗體變體包含F405L或K409R突變,如實施例1所述。細胞(1x105細胞/孔)在聚苯乙烯96-孔圓底板(Greinerbio-one650101)上用在100μLPBS/0.1%BSA/0.02%疊氮化物中連續稀釋的抗體制備物(范圍5-10,000ng/mL,以3-倍稀釋)在4℃孵育30min。在用PBS/0.1%BSA/0.02%疊氮化物洗滌兩次后,細胞在100μL中用第二抗體在4℃孵育30min。作為第二抗體,在PBS/0.1%BSA/0.02%疊氮化物中以1/100稀釋的R-藻紅蛋白(PE)-綴合的山羊-抗-人IgGF(ab’)2(109-116-098,JacksonImmunoResearchLaboratories,Inc.,WestGrove,PA)用于所有實驗。接著,細胞在PBS/0.1%BSA/0.02%疊氮化物中洗滌兩次,重懸于150μLPBS/0.1%BSA/0.02%疊氮化物和在FACSCantoll(BDBiosciences)上分析。結合曲線使用非線性回歸(S形劑量反應,具有可變斜率)使用GraphPadPrismV5.04軟件(GraphPadSoftware,SanDiego,CA,USA)進行分析。圖1A顯示具有野生型Fc區的IgG1λ-huCD3變體IgG1-huCD3-H1L1(分別為SEQIDNO:6和10)、IgG1-huCD3-H1L2(分別為SEQIDNO:6和11)、IgG1-huCD3-H1L3(分別為SEQIDNO:6和12)、IgG1-huCD3-H3L3(分別為SEQIDNO:8和12)和IgG1-huCD3-H4L1(分別為SEQIDNO:9和10)與Jurkat細胞的結合對于所有變體都觀察到,和IgG1-CD3-LFLEDA(實施例1所述的親本CD3抗體,具有非-激活的LFLEDA突變)和具有非-激活的LFLEDA突變的IgG1-huCD3-H3L1-LFLEDA的結合能力類似于具有野生型Fc區的huCD3變體。與IgG1-huCD3變體相比,作為陽性對照包括的IgG1-huCLB-T3/4與Jurkat細胞的結合更強。對于陰性對照抗體IgG1-b12,未觀察到結合。圖6A顯示具有非-激活的LFLEDA突變的IgG1-CD3-LFLEDA(實施例1所述的親本CD3抗體,具有非-激活的LFLEDA突變)、IgG1-huCD3-H3L1-LFLEDA、IgG1-huCD3-H3L3-LFLEDA、IgG1-3huCD3-H1L1-LFLEDA、IgG1-huCD3-H1L3-LFLEDA、IgG1-huCD3-H4L1-LFLEDA和IgG1-huCD3-H4L3-LFLEDA與Jurkat細胞的結合類似于具有野生型Fc區的huCD3變體的結合能力。作為陽性對照包括的IgG1-huCLB-T3/4與Jurkat細胞的結合,與IgG1-huCD3變體相比在低抗體濃度時更強,但在較高的抗體濃度下類似。總體上,人源化CD3變體保持了作為IgG1-CD3抗體與CD3的結合能力。對于陰性對照抗體IgG1-b12,未觀察到結合。圖1B顯示雙特異性抗體變體bsIgG1CD3xHER2、bsIgG1CD3xb12-LFLEDA和bsIgG1huCD3-H3L1xHER2-LFLEDA也結合Jurkat細胞。這些雙特異性抗體的最大結合值高于單特異性抗體的最大結合值。雙特異性抗體的EC50濃度為6-10倍。再次,對于陰性對照抗體IgG1-b12,未觀察到結合。圖6B顯示雙特異性非-激活的Fc抗體變體bsIgG1huCD3-H3L1xHER2-LFLEDA、bsIgG1-huCD3-H3L3xHER2-LFLEDA、bsIgG1-huCD3-H1L1xHER2-LFLEDA、bsIgG1-huCD3-H1L3xHER2-LFLEDA、bsIgG1-huCD3-H4L1xHER2-LFLEDA和bsIgG1-huCD3-H4L3xHER2-LFLEDA也結合Jurkat細胞。這些雙特異性抗體的最大結合值高于單特異性抗體的最大結合值。雙特異性抗體的EC50濃度為4-10倍。單價結合允許更多抗體聚集在細胞表面上,因此,允許雙特異性抗體的較高的結合值。再次,對于陰性對照抗體IgG1-b12,未觀察到結合。圖2A顯示具有野生型Fc區的IgG1-huCD3變體IgG1-huCD3-H1L1、IgG1-huCD3-H1L2、IgG1-huCD3-H1L3、IgG1-huCD3-H3L3和IgG1-huCD3-H4L1,和IgG1-CD3-LFLEDA、IgG1-huCD3-H3L1-LFLEDA與食蟹猴T細胞系HSC-F的結合是類似的。對于不與食蟹猴CD3交叉反應的對照抗體huCLB-T3/4,和陰性對照抗體IgG1-b12,未觀察到結合。圖7A顯示IgG1-huCD3變體IgG1-CD3-LFLEDA、IgG1-huCD3-H3L1-LFLEDA、IgG1-huCD3-H3L3-LFLEDA、IgG1-huCD3-H1L1-LFLEDA、IgG1-huCD3-H1L3-LFLEDA、IgG1-huCD3-H4L1-LFLEDA和IgG1-huCD3-H4L3-LFLEDA與食蟹猴T細胞系HSC-F的結合是類似的。對于陰性對照抗體IgG1-b12,未觀察到結合。圖2B顯示雙特異性抗體變體bsIgG1CD3xHER2和bsIgG1huCD3-H3L1-LFLEDA也結合HSC-F細胞。這些雙特異性抗體的最大結合值高于單特異性抗-CD3變體的最大結合值。雙特異性抗體的EC50濃度為單特異性抗-CD3抗體的10-12倍。再次,對于陰性對照抗體IgG1-b12,未觀察到結合。圖7B顯示雙特異性非-激活的Fc抗體變體bsIgG1huCD3-H3L1xHER2-LFLEDA、bsIgG1-huCD3-H3L3xHER2-LFLEDA、bsIgG1-huCD3-H1L1xHER2-LFLEDA、bsIgG1-huCD3-H1L3xHER2-LFLEDA、bsIgG1-huCD3-H4L1xHER2-LFLEDA和bsIgG1-huCD3-H4L3xHER2-LFLEDA也結合HSC-F細胞。這些雙特異性抗體的最大結合值高于單特異性抗-CD3變體的最大結合值。雙特異性抗體的EC50濃度是單特異性抗-huCD3抗體的3-6倍。再次,對于陰性對照抗體IgG1-b12,未觀察到結合。實施例3–通過人源化CD3抗體變體的T細胞活化CD69表達是T細胞活化的早期標志物。通過T細胞表達的CD3和免疫細胞表達的Fc受體經由抗體的Fc區例如IgG1Fc區的結合,CD3抗體可介導T細胞和免疫細胞的交聯。這可導致T細胞活化和CD69的誘導。包含非-激活的Fc區的抗體變體(LFLEDA突變)不結合Fc受體。因此,預期非-激活的CD3抗體不誘導T細胞活化和CD69表達,這是因為非-激活的Fc區不結合表達Fc受體的免疫細胞,和因此不能交聯T細胞和免疫細胞。在用含有和沒有Fc區的LFLEDA突變的人源化CD3(huCD3)變體孵育后,T細胞上的CD69表達通過FACS分析進行評價,以確定T細胞的早期活化。除了非-激活的突變之外,LFLEDA變體還包含F405L或K409R突變,如實施例1中所述。通過密度梯度分離使用Leucosep管(#227290;GreinerBio-one,Alphena/dRijn,TheNetherlands)自全血或血沉棕黃層分離PBMC,用PBS洗滌和重懸于培養基中。將劑量反應系列的huCD3抗體變體、陰性對照(IgG1-b12)和陽性對照(IgE-huCD3和親本IgG1-CD3)在培養基中制備(范圍0.1-1,000ng/mL,以10倍稀釋),和加入到包含人或食蟹猴PBMC的96-孔圓底板的各孔。在16-24小時孵育后,通過離心將細胞沉淀,和收集上清液(含有細胞因子)和在-20℃貯存。然后用PBS/0.1%BSA/0.02%疊氮化物洗滌細胞和在4℃用小鼠-抗-人CD28-PE(854.222.010;Sanquin,Amsterdam,TheNetherlands;T細胞標志物)和小鼠-抗-人CD69-APC抗體(340560;BDBiosciences,FranklinLakes,NJ)染色30分鐘,它們分別與食蟹猴CD28和CD69交叉反應。未結合的抗體通過用PBS/0.1%BSA/0.02%疊氮化物洗滌兩次除去。將細胞以150μL/孔重懸,和CD28陽性細胞上的CD69表達在FACSCantoII(BDBiosciences)上測量。圖3顯示具有野生型IgG1Fc區的IgG1-CD3(如實施例1所述)和人源化IgG1-huCD3變體在來自人(圖3A)和食蟹猴(圖3B)來源的T細胞上誘導類似水平的CD69表達。非-激活的(LFLEDA)IgG1-CD3-LFLEDA和IgG1-huCD3-H3L1變體在人T細胞中誘導低水平的CD69表達。通過非-激活的IgG1-huCD3變體在食蟹猴T細胞中不誘導CD69表達。對照抗體IgG1-b12在人或食蟹猴T細胞中也不誘導CD69的表達。圖8顯示非-激活的(LFLEDA)IgG1-huCD3-H3L1-LFLEDA、IgG1-huCD3-H3L3-LFLEDA、IgG1-3huCD3-H1L1-LFLEDA、IgG1-huCD3-H1L3-LFLEDA、IgG1-huCD3-H4L1-LFLEDA和IgG1-huCD3-H4L3-LFLEDA變體在人T細胞中誘導低水平的CD69表達。圖8A和8B顯示在來自食蟹猴的T細胞上誘導CD69表達。觀察到的通過非-激活的變體的較少活化可能是由于通過CD3抗體的二價結合導致的CD3分子的交聯。這樣的解釋通過以下觀察結果得到支持:在最高濃度下活化減少,此時抗體結合是單價的。對照抗體IgG1-b12也未在人或食蟹猴T細胞中誘導CD69的表達。圖8C和8D顯示非-激活的雙特異性抗體變體bsIgG1-huCD3-H3L1xHER2-LFLEDA、bsIgG1-huCD3-H3L3xHER2-LFLEDA、bsIgG1-huCD3-H1L1xHER2-LFLEDA、bsIgG1-huCD3-H1L3xHER2-LFLEDA、bsIgG1-huCD3-H4L1xHER2-LFLEDA和bsIgG1-huCD3-H4L3xHER2-LFLEDA不誘導在來自人(圖8C)或食蟹猴(圖8D)的T細胞中CD69的表達。然而,在較高的抗體濃度下觀察到CD69表達的一些誘導。實施例4–通過人源化CD3抗體變體誘導的T-細胞增殖人源化CD3(huCD3)抗體變體(描述于實施例1)對人和食蟹猴T細胞的增殖的作用通過來自RocheAppliedScience的細胞增殖ELISA試劑盒來評價(細胞增殖ELISA,BrdU試劑盒,#11647229001;RocheAppliedScience,Mannheim,Germany),其按照制造商的說明書進行。自全血或血沉棕黃層分離的人或食蟹猴PBMC在96-孔培養板中用稀釋系列(范圍0.1-1,000ng/mL,按10倍稀釋)的IgG1huCD3抗體變體孵育。包括IgE-CD3和IgG1-huCLB-T3/4作為陽性對照和IgG1-b12作為陰性對照。用抗體孵育3天后,加入BrdU(RocheAppliedScience,Mannheim,Germany)至培養基,和將板孵育5小時。然后通過離心將細胞沉淀,和收集上清液并在-20℃貯存。將板干燥和在4℃貯存,直到進行ELISA。DNA中的BrdU摻入根據制造商的說明書(RocheAppliedScience)通過ELISA測定。將細胞固定至板上,之后在室溫用與過氧化物酶綴合的抗-BrdU抗體將板孵育90分鐘。將板用PBST洗滌和使用ABTS緩沖液(代替試劑盒提供的TMB溶液)檢測結合。30min后通過加入2%草酸至各孔,終止顯色。然后在EL808ELISA-閱讀器上測量OD405nm。圖4顯示用具有野生型IgG1Fc區的親本IgG1-CD3和人源化IgG1-huCD3變體孵育PBMC誘導人(圖4A)和食蟹猴(圖4B)T細胞的強增殖,甚至在極低濃度的抗體時。用IgG1-huCD3抗體的非-激活的LFLEDA變體孵育不誘導人T細胞(圖4A和9A)或食蟹猴T細胞(圖4B和9B)的增殖。因此,盡管IgG1-huCD3抗體的非-激活的變體誘導在人T細胞中低水平的CD69表達(如實施例3所示),通過這些非-激活的IgG1-huCD3變體不誘導人T細胞的增殖。圖9C和9D顯示非-激活的雙特異性抗體變體bsIgG1-huCD3-H3L1xHER2-LFLEDA、bsIgG1-huCD3-H3L3xHER2-LFLEDA、bsIgG1-huCD3-H1L1xHER2-LFLEDA、bsIgG1-huCD3-H1L3xHER2-LFLEDA、bsIgG1-huCD3-H4L1xHER2-LFLEDA和bsIgG1-huCD3-H4L3xHER2-LFLEDA不誘導自人(圖9C)或食蟹猴(圖9D)分離的T細胞的增殖。實施例5–通過人源化CD3抗體變體誘導的體外T細胞介導的細胞毒性腫瘤特異性T細胞細胞毒性可通過一個臂與CD3結合和另一個臂與腫瘤特異性靶標例如HER2結合的雙特異性抗體介導。雙特異性抗體同時結合T細胞和腫瘤細胞兩者將導致T細胞活化和腫瘤細胞特異性細胞毒性。在本實施例中,針對HER2-陽性腫瘤細胞的T細胞介導的細胞毒性使用針對CD3(人源化變體)和HER2的雙特異性抗體進行評價。因此,AU565(人乳腺癌)細胞在補充10%(vol/vol)熱滅活的CCS、1.5g/L碳酸氫鈉(Lonza)、1mM丙酮酸鈉、4.5g/L葡萄糖(Sigma)、50IU/mL青霉素和50μg/mL鏈霉素的RPMI1640中培養。將細胞系保持在37℃在5%(vol/vol)CO2潮濕孵育器中。AU565細胞培養至接近匯合,之后細胞經受胰蛋白酶處理,再懸浮于培養基中和通過細胞過濾器獲得單細胞懸液。將5x104細胞接種至96-孔培養板的各孔,和細胞在37℃,5%CO2孵育至少3小時,以允許附著至板上。人或食蟹猴PBMC自全血或血沉棕黃層分離。分離的PBMC用PBS洗滌,再懸浮于培養基中和按1:1比率添加至在96-孔板中的AU565腫瘤細胞。PBMC中存在的T細胞的百分比使用小鼠抗-人CD3-PerCP(BD,#345766)抗體(用于染色T細胞)通過FACS-分析測量,該抗體與食蟹猴CD3交叉反應。使用的PBMC群中的T細胞含量通常為50-60%。稀釋系列(終濃度范圍0.001直至10,000ng/mL)的雙特異性抗體變體bsIgG1CD3xHER2-LFLEDA、bsIgG1CD3xb12-LFLEDA、bsIgG1huCD3-H3L1xHER2-LFLEDA、bsIgG1-huCD3-H3L3xHER2-LFLEDA、bsIgG1-huCD3-H1L1xHER2-LFLEDA、bsIgG1-huCD3-H1L3xHER2-LFLEDA、bsIgG1-huCD3-H4L1xHER2-LFLEDA和bsIgG1-huCD3-H4L3xHER2-LFLEDA在培養基中制備和加入板中。包括IgG1-HER2-LFLEDA和IgG1-b12作為對照。除了非-激活的突變之外,LFLEDA抗體變體包含F405L或K409R突變,用于以雙特異性形式制備(見實施例1)。將板在37℃,5%CO2孵育3天。細胞用1μM星孢素(#S6942-200,Sigma)孵育,作為100%腫瘤細胞殺死的參考使用。板用PBS洗滌兩次,和包含10%Alamarblue的150μL培養基加入各孔。將板在37℃,5%CO2孵育4小時。測量590nm的吸光度(Envision,PerkinElmer,Waltham,MA)。雙特異性CD3xHER2-LFLEDA抗體變體(bsIgG1-huCLB-T3/4xHER2-LFLEDA和bsIgG1-CD3xHER2-LFLEDA)在低濃度時使用人效應細胞(圖5A)或食蟹猴效應細胞(圖5B)誘導殺死AU565細胞。CD3雙特異性對照抗體huCLB-T3/4xHER2-LFLEDA,其顯示與食蟹猴CD3無交叉反應,僅當使用人PBMC時誘導殺死AU565細胞(圖5A)。因此,當食蟹猴效應細胞用于該測定法時未觀察到殺死靶細胞(圖5B)。用單特異性IGG1-b12或IgG1-HER2-LFLEDA或bsIgG1-CD3xb12-LFLEDA抗體孵育不誘導靶細胞的非特異性殺死。雙特異性抗體變體bsIgG1huCD3-H3L1xHER2-LFLEDA、bsIgG1-huCD3-H3L3xHER2-LFLEDA、bsIgG1-huCD3-H1L1xHER2-LFLEDA、bsIgG1-huCD3-H1L3xHER2-LFLEDA、bsIgG1-huCD3-H4L1xHER2-LFLEDA和bsIgG1-huCD3-H4L3xHER2-LFLEDA在低濃度時使用人效應細胞(圖10A)或食蟹猴效應細胞(圖10B)誘導殺死AU565細胞。用單特異性IgG1-b12或IgG1-HER2-LFLEDA抗體孵育不誘導非特異性靶細胞殺死(圖10A和B)。因此,包含非-激活的Fc區的人源化CD3變體不誘導非特異性靶細胞殺死,這表明包含非-激活的Fc區的變體可用于確保靶向的T細胞活化和因此避免非-靶向的T細胞活化。實施例6–通過人源化CD3抗體變體的恒河猴T細胞活化在用具有野生型IgG1Fc區的人源化CD3(huCD3)抗體變體孵育后,評價在恒河猴T細胞上的CD69表達以確定T細胞的早期活化。通過流式細胞術分離恒河猴PBMC和評價CD69表達按實施例3所述進行。圖11顯示人源化CD3抗體變體IgG1-huCD3-H1L1、IgG1-huCD3-H1L2、IgG1-huCD3-H1L3、IgG1-huCD3-H3L3和IgG1-huCD3-H4L1誘導在恒河猴來源的T細胞上的CD69表達至類似于IgG1-CD3(如實施例1所述)的水平。陰性對照抗體IgG1-b12不誘導在恒河猴T細胞中CD69的表達。因此,本發明的huCD3變體可用于涉及恒河猴CD3的實驗。huCD3變體與恒河猴CD3交叉反應。實施例7-通過huCLB-T3/4的非-激活的變體的T細胞活化在用具有Fc區突變的IgG1-huCLB-T3/4變體(見實施例1)孵育后,T細胞上的CD69表達通過FACS分析進行評價以確定T細胞的早期活化。通過密度梯度分離使用Leucosep管(#227290;GreinerBio-one,Alphena/dRijn,TheNetherlands)自全血或血沉棕黃層分離PBMC,用PBS洗滌和重懸浮于培養基中。劑量反應系列的IgG1-huCLB-T3/4變體、陰性對照(IgG1-huCLB-T3/4-Fab)和陽性對照(IgE-huCLB-T3/4)在培養基中制備(范圍1-1000ng/mL,以3倍稀釋),和加入到包含PBMC的96-孔圓底板的各孔。在16-24小時孵育后,通過離心將細胞沉淀,和收集上清液(包含細胞因子)和在-20℃貯存。然后細胞用PBS/0.1%BSA/0.02%疊氮化物洗滌,和在4℃用小鼠-抗-人CD28-PE(854.222.010;Sanquin,Amsterdam,TheNetherlands;T細胞標志物)和小鼠-抗-人CD69-APC抗體(340560;BDBiosciences,FranklinLakes,NJ)染色30分鐘。未結合的抗體通過用PBS/0.1%BSA/0.02%疊氮化物洗滌兩次除去。將細胞重懸浮于150μL/孔和在FACSCantoII(BDBiosciences)上測量CD28陽性細胞上的CD69-表達。圖12A顯示在用IgE-huCLB-T3/4、IgG1-huCLB-T3/4、IgG1-huCLB-T3/4-DA和IgG1-huCLB-T3/4-DAPS孵育的細胞上CD69表達高。與野生型IgG1-huCLB-T3/4相比,用IgG1-huCLB-T3/4-N297Q孵育誘導略微較低的CD69表達水平,和用IgG1-huCLB-T3/4-LFLE和IgG1-huCLB-T3/4-LFLEPS孵育誘導CD69至更低程度。PBMC用IgG1-CD3Fab、IgG1-huCLB-T3/4-LFLEDA、IgG1-huCLB-T3/4-LFLENQ、IgG1-huCLB-T3/4-DANQ和IgG1-huCLB-T3/4-LFLEDANQPS抗體孵育不誘導T細胞上的CD69的任何表達。圖12B顯示在用IgE-huCLB-T3/4和IgG1-huCLB-T3/4孵育的細胞上CD69表達高。與野生型IgG1-huCLB-T3/4相比,用IgG1-huCLB-T3/4-LALA孵育誘導略微較低的CD69表達水平,和用IgG1-huCLB-T3/4-LFLEDA和IgG1-b12(陰性對照)孵育不誘導T細胞上的CD69的任何表達。實施例8–通過huCLB-T3/4的非-激活的變體的T-細胞增殖huCLB-T3/4變體(描述于實施例1)對T細胞增殖的作用通過來自RocheAppliedScience的細胞增殖ELISA試劑盒(細胞增殖ELISA,BrdU試劑盒,#11647229001;RocheAppliedScience,Mannheim,Germany)進行評價,其按照制造商的說明書進行。自全血或血沉棕黃層分離的PBMC在96-孔培養板中用稀釋系列(范圍0.1-1000ng/mL)的IgG1-CD3變體孵育。包括IgE-CD3和IgG1-CD3作為陽性對照和IgG1-b12(具有K409R突變用于產生雙特異性抗體)作為陰性對照。用抗體孵育3天后,將BrdU(RocheAppliedScience,Mannheim,Germany)加入培養基,和將板孵育5小時。然后通過離心將細胞沉淀,和收集上清液和在-20℃貯存。將板干燥和在4℃貯存直至進行ELISA。DNA中的BrdU摻入通過ELISA根據制造商的說明書測定(細胞增殖ELISA,BrdU試劑盒,#11647229001;RocheAppliedScience)。將細胞固定至板上,之后在室溫(RT)用與過氧化物酶綴合的抗-BrdU抗體將板孵育90分鐘。板用PBST洗滌,和使用ABTS緩沖液(代替試劑盒提供的TMB溶液)測定結合。在30min后通過加入2%草酸至各孔終止顯色。然后在EL808ELISA-閱讀器上測量OD405nm。圖13A顯示PBMC用IgG1-huCLB-T3/4、IgG1-huCLB-T3/4-DA和IgG1-huCLB-T3/4-DAPS孵育誘導T細胞的強增殖,甚至在極低濃度的抗體時。用IgG1-huCLB-T3/4-N297Q孵育誘導劑量依賴性增殖,這與IgE-huCLB-T3/4陽性對照相當。PBMC用IgG1-huCLB-T3/4-Fab、IgG1-b12-N297Q、IgG1-huCLB-T3/4-LFLE、IgG1-huCLB-T3/4-LFLEDA、IgG1-huCLB-T3/4-LFLENQ、IgG1-huCLB-T3/4-LFLEPS、IgG1-huCLB-T3/4-DANQ和IgG1-huCLB-T3/4-LFLEDANQPS抗體孵育不誘導T細胞的增殖。圖13B顯示PBMC用IgG1-huCLB-T3/4孵育誘導T細胞的強增殖,甚至在極低濃度的抗體時。用IgE-huCLB-T3/4(陽性對照)和IgG1-huCLB-T3/4-LALA孵育誘導劑量依賴性增殖。PBMC用IgG1-huCLB-T3/4-LFLEDA孵育不誘導T細胞的增殖。根據實施例7和8的結果,被視為最少激活的一個突變體亞組進行進一步分析。實施例9–通過非-激活的抗體變體huCLB-T3/4誘導的體外T細胞介導的細胞毒性AU565(人乳腺癌)細胞在補充10%(vol/vol)熱滅活的CCS、1.5g/L碳酸氫鈉(Lonza)、1mM丙酮酸鈉、4.5g/L葡萄糖(Sigma)、50IU/mL青霉素和50μg/mL鏈霉素的RPMI1640中孵育。將細胞系保持在37℃在5%(vol/vol)CO2潮濕孵育器中。AU565細胞培養至接近匯合。細胞經受胰蛋白酶處理,再懸浮于培養基和通過細胞過濾器獲得單細胞懸液。將5x104細胞接種至96-孔培養板的各孔,和將細胞在37oC,5%CO2孵育至少3小時,以允許附著至板上。使用Leucosep30mL管根據制造商的方案(GreinerBio-one),外周血單核細胞(PBMC)自健康志愿者的血液分離。分離的PBMC用PBS洗滌,重懸浮于培養基和按1:1比率加入96-孔板中的AU565腫瘤細胞。PBMC中存在的T細胞的百分比通過FACS-分析使用小鼠抗-人CD3-PerCP(BD,#345766)抗體(用于染色T細胞)測量。使用的PBMC群中的T細胞含量通常為50-60%。稀釋系列(終濃度范圍0.004-1000ng/mL)的IgG1-b12、IgG1-huCLB-T3/4、IgG1-HER2和雙特異性huCLB-T3/4xb12和huCLB-T3/4xHER2抗體,表示為不同的Fc-變體、野生型、N297Q、LFLE、LALA、LFLENQ、LFLEDA、DANQ和LFLEDENQPS,在培養基中制備,和加入至板中。將板在37oC,5%CO2孵育3天。細胞用1μM星孢素(#S6942-200,Sigma)孵育,用作100%腫瘤細胞殺死的參考。孵育后,除去上清液,和在-20℃貯存。將板用PBS洗滌兩次,和包含10%Alamarblue的150μL培養基加入各孔。將板在37oC,5%CO2孵育4小時。測量590nm的吸光度(Envision,PerkinElmer,Waltham,MA)。使用來自不同供體的PBMC進行兩個實驗。在第一個實驗中,測試Fc-變體N297Q、LFLE、LFLENQ、LFLEDA、DANQ和LFLEDANQPS(圖14A-G)。在第二個實驗中,測試Fc-變體LFLEDA和LALA(圖15A-C)。在兩個實驗中包括具有野生型Fc-結構域的抗體作為參考。用野生型單特異性IgG1-huCLB-T3/4或雙特異性huCLB-T3/4xb12抗體孵育誘導靶細胞的非特異性殺死(圖14A-G和15A-C)。單特異性IgG1-huCLB-T3/4和bsIgG1-huCLB-T3/4xb12變體N297Q(圖14A-G)和LALA(圖15A-C)仍誘導一些非特異性靶細胞殺死,雖然比在同一實驗中測試的野生型抗體的程度低。非特異性靶細胞殺死不被任何其它測試的具有非-激活的突變的IgG1-huCLB-T3/4或bsIgG1-huCLB-T3/4xb12抗體誘導(圖14A-G和15A-C)。所有雙特異性huCLB-T3/4xHER2抗體誘導AU565細胞的劑量依賴性殺死,與沒有非-激活的突變的野生型雙特異性huCLB-T3/4xHER2抗體相比具有至少相當的功效(圖14A-G和15A-C)。在極低濃度時發生最大殺死。通過單特異性b12或HER2抗體的野生型或非-激活的變體不誘導細胞毒性(圖14A-G和15A-C),這如所期望的。實施例10–C1q與huCLB-T3/4的非-激活的抗體變體的結合的評價C1q與結合至靶細胞的抗體的相互作用是補體活化的經典途徑的第一步。因為野生型IgG1包含C1q的相互作用位點,因此C1q與這些非-激活的IgG1變體的相互作用通過ELISA進行評價。在4℃將稀釋系列(范圍7-30,000ng/mL,以4倍稀釋)的IgG1-huCLB-T3/4、bsIgG1-huCLB-T3/4xHER2和IgG1-CD20(陽性對照)和如上文實施例1所述的其非-激活的抗體變體包被在96-孔MicrolonELISA板(Greiner,Germany)上過夜。將板洗滌,和用補充0.025%Tween20和0.1%明膠的PBS封閉。將板序貫用3%混合人血清(Sanquin,product#M0008)在37?C孵育1h,用100μL/孔兔抗-人C1q(DAKO,product#A0136,1/4,000)在室溫孵育1h,和用100μL/孔豬抗-兔IgG-HRP(DAKO,P0399,1:10,000)作為檢測抗體在室溫孵育1h,在孵育之間進行洗滌。通過加入1mg/mL2,2’-連氮基-雙(3-乙基苯并噻唑啉-6-磺酸)(ABTS;Roche,Mannheim,Germany)約30min進行檢測。通過加入100μL2%草酸終止反應。在微板閱讀器中(Biotek,Winooski,VT)測量405nm的吸光度。Log變換數據通過使用GraphPadPrism軟件擬合具有可變斜率的S形劑量反應曲線進行分析。圖16A顯示具有野生型IgG1Fc區的抗體IgG1-CD20和IgG1-huCLB-T3/4顯示C1q結合。在所有評價的具有非-激活的突變的抗體變體(N297Q,LFLE,LFLENQ,LFLEDA,DA,DAPS,DANQ,LFLEPS,LFLEDANQPS,LALA)中未檢出C1q的結合。圖16B顯示具有野生型IgG1Fc區的抗體bsIgG1-huCLB-T3/4xHER2顯示C1q結合。在所有評價的具有非-激活的突變的抗體變體(N297Q,LFLE,LFLENQ,LFLEDA,DA,DAPS,DANQ,LFLEPS,LFLEDANQPS,LALA)中未檢出C1q的結合。圖16C和圖16D顯示具有野生型IgG1Fc區的抗體IgG1-CD20、IgG1-huCLB-T3/4和bsIgG1-huCLB-T3/4xHER2顯示C1q結合。在具有非-激活的突變的抗體變體(LFLEDA和LALA)中未檢出C1q的結合。實施例11–非-激活的抗體變體的藥代動力學(PK)分析將該研究中的小鼠飼養在CentralLaboratoryAnimalFacility(Utrecht,TheNetherlands)的隔離單元中,和保持在頂部凈化籠中,無限制提供水和食物。所有實驗獲得UtrechtUniversity動物倫理委員會的批準。7-10周齡C.B-17SCID小鼠(C.B-17/Icr-Prkdc<Scid>/IcrIcoCrl,Charles-River)靜脈內注射100μg野生型抗體(IgG1-huCLB-T3/4,IgG1-HER2,或bsIgG-huCLB-T3/4xHER2)或其非-激活的變體(LALA,LFLEDA,LFLENQ,DANQ或LFLEDANQPS),使用3只小鼠/組。在抗體給予后10分鐘、4小時、1天、2天、7天、14天和21天,自隱靜脈收集50μL血液樣品。收集血液至含肝素的小瓶,和以10,000xg離心5分鐘。血漿貯存在–20℃直到測定抗體濃度。人IgG濃度使用總hIgG夾心ELISA測定。對于該測定,小鼠mAb抗-人IgG-kappa克隆MH16(#M1268,CLBSanquin,TheNetherlands),以濃度2μg/mL包被在96-孔MicrolonELISA板(Greiner,Germany)上,用作捕獲抗體。用補充0.2%牛血清白蛋白的PBS封閉板后,加入用ELISA緩沖液(補充0.05%Tween20和0.2%牛血清白蛋白的PBS)連續稀釋的樣品,和在板振蕩器上在室溫(RT)孵育1h。隨后用山羊抗-人IgG免疫球蛋白(#109-035-098,Jackson,WestGrace,PA)孵育板,和用2,2’-連氮基-雙(3-乙基苯并噻唑啉-6-磺酸)(ABTS;Roche,Mannheim,Germany)顯色。30min后通過加入2%草酸至各孔終止反應。在微板閱讀器中(Biotek,Winooski,VT)測量405nm的吸光度。血漿清除率(mL/天/kg)基于曲線下面積(AUC),根據以下方程式來計算:數據分析使用Graphpadprism軟件進行。圖17A顯示當與野生型抗體相比時,對于抗體變體N297Q、DANQ、LFLENQ和LFLEDANQPS,血漿人IgG濃度更低,表明更快速的清除率。對于抗體變體LFLEDA和LALA,血漿中人IgG濃度類似于野生型抗體。圖17B表明抗體變體N297Q、DANQ和LFLENQ的血漿清除率是野生型抗體的2-3倍。抗體變體LFLEDANQPS的清除率是野生型抗體的3-5倍。抗體變體LFLEDA和LALA的血漿清除率類似于野生型抗體。實施例12–IgG1-LFLEDA骨架的體外免疫原性評價為了確定IgG1-LFLEDA-K409R骨架的臨床免疫原性的可能性,將Antitope的EpiScreen?平臺應用于IgG1-HER2-LFLEDA。簡言之,自代表歐洲和北美洲人群的一組50個HLA-型健康供體分離PBMC。在CD8+T細胞耗盡后,將PBMC群單獨冷凍和貯存。隨后培養解凍的PBMC,和用IgG1-HER2-LFLEDA-K409R或對照樣品之一(IgG1-HER2或IgG1-HER2-LFLE-K409R)孵育5-8天。樣品誘導CD4+T細胞反應的能力通過測量細胞增殖([3H]-胸苷摻入)和IL-2產生(ELISpot測定)來評價。在兩種測定中顯示刺激指數(SI;信號/基線信號)≥1.9的反應的供體被視為陽性。EpiScreen?分析表明,對于IgG1-HER2-LFLEDA,4名供體(8%)顯示陽性CD4+T細胞反應,這與對于IgG1-HER2和IgG1-HER2-LFLE分別為4(8%)和3(6%)個陽性反應相當(圖18)。因此,IgG1-HER2-LFLEDA-K409R(以及IgG1-HER2和IgG1-HER2-LFLE-K409R)顯示低的免疫原性可能性,反應頻率低于10%。陽性對照人源化A33(例如[84])用作臨床基準對照抗體,其在臨床上顯示高水平的免疫原性和通常在EpiScreen測定中誘導20-30%T細胞反應。實施例13–產生突變體以優化人源化CD3抗體的產生產生huCD3-L1突變體質粒產生數個IgG1-huCD3-L1LC突變體以改進在瞬時轉染測定中IgG1-huCD3-H1L1的表達水平,參見表2。殘基的選擇基于:與種系序列的比較或huCD3-L1中稀有殘基的存在情況的篩選,以及來自同源抗體的晶體結構。選擇的序列在GeneArt(LifeTechnologies,Germany)合成。p33L編碼SEQIDNO:31的人IgLC2/IgLC3λ輕鏈的恒定結構域。p33G1f編碼SEQIDNO:15的IgG1m(f)重鏈恒定區。表2在Expi293F細胞中瞬時表達對于單一抗體,使用ExpiFectamine293(Lifetechnologies)將編碼重鏈(HC)和輕鏈(LC)的質粒瞬時轉染至FreestyleExpi293F細胞(Lifetechnologies,USA)。將總共1.5μgHC編碼質粒和1.5μgLC編碼質粒(表2)稀釋于150μLOpti-MEM(Gibco,USA)。為了制備轉染混合物,將8μLExpiFectamine293稀釋于150μLOpti-MEM和在室溫下孵育5分鐘。接著,DNA/Opti-MEM和ExpiFectamine293/Opti-MEM溶液混合,在室溫下孵育20分鐘和加入至2.55mL包含7.5x106Expi293F細胞和50U/mLPen-Strep的Expi293表達培養基。將細胞在37℃,8%CO2孵育和以200rpm搖振。為提高表達,轉染后21小時,加入15μL強化混合物1和150μL強化混合物2。細胞孵育4天,接著收獲上清液。將上清液以3,000xg離心和經0.2μm過濾器過濾除菌。在OctetRED(ForteBio,US)上使用抗-人IgG傳感器(ForteBio,USA)測量IgG表達水平。IgG濃度分析對于所列的所有突變體,單獨或組合測量IgG表達水平。圖20顯示對于表2所列的表達的抗體組,上清液中測量的IgG表達水平。IgG1-huCD3-H1L1抗體表達至72μg/mL。對于IgG1-huCD3-H1L1-LT41K突變體,觀察到IgG表達4-倍增加(295μg/mL)。對于尤其包括T41K突變的IgG1-huCD3-H1L1-LLKNH突變體,觀察到類似的表達水平(311μg/mL)。與IgG1-huCD3-H1L1相比,當單獨測試時,這些構建體中的其它突變未顯示表達提高(IgG1-huCD3-H1L1-LF10L、IgG1-huCD3-H1L1-LK55N、IgG1-huCD3-H1L1-LL97H)。對于R23A和A35P的組合,觀察到第二組提高表達的突變。盡管缺少R23A和A35P的IgG1-huCD3-H1L1-LLTGPEAEY形式未顯示提高的表達(83μg/mL),但包含另外的R23A和A35P突變的IgG1-huCD3-H1L1-LLAPTGPEAEY的確顯示3倍表達增加(237μg/mL)。單獨地,R23A或A35P未顯示提高的表達水平(分別為56和81μg/mL)。實施例14-huCD3-H1L1-LFLEDA變體與Jurkat細胞的結合測試了huCD3-H1L1-LFLEDA變體與Jurkat細胞的表觀結合親和力。公開于US2012038219的IgG1-CD3-hmAb286用作參考抗體。將Jurkat細胞(DSMZ,Brunswick,Germany)在37℃解凍,和用30mLPBS洗滌一次和以300xg在4℃離心10分鐘。將細胞沉淀重懸于25mLPBS/0.1%BSA/0.02%疊氮化物,終濃度為0.8x106細胞/mL。將100μL的該細胞懸液(0.8x105細胞/孔)轉移至聚苯乙烯96-孔圓底板(GreinerBio-one,Alphena/dRijn,TheNetherlands),和用在PBS/0.1%BSA/0.02%疊氮化物中連續稀釋的上清液制備物(范圍3-10,000ng/mL,以3倍稀釋)在4℃孵育30分鐘。用PBS/0.1%BSA/0.02%疊氮化物洗滌三次后,Jurkat細胞以50μL用第二抗體在4℃孵育30min。作為第二抗體,在PBS/0.1%BSA/0.02%疊氮化物中按1/200稀釋的R-藻紅蛋白(PE)-綴合的山羊-抗-人IgGF(ab’)2(JacksonImmunoResearchLaboratories,Inc.,WestGrove,PA)用于所有實驗。接著,Jurkat細胞用PBS/0.1%BSA/0.02%疊氮化物洗滌兩次,重懸于150μLPBS/0.1%BSA/0.02%疊氮化物和在FACSCantoll(BDBiosciences)上進行分析。使用非線性回歸(S形劑量反應,具有可變斜率)使用GraphPadPrismV5.04軟件(GraphPadSoftware,SanDiego,CA,USA),分析結合曲線。圖21顯示結合曲線,和表3顯示IgG1-huCD3-H1L1-LFLEDA突變體的EC50值。T41K突變對結合親和力沒有影響,而K55N和LKNH突變體顯示表觀親和力是野生型IgG1-huCD3-H1L1-LFLEDA的1/5。參考抗體IgG1-CD3-hmAb286-LFLEDA的親和力低于IgG1-huCD3-H1L1-LFLEDA,和類似于包含K55N突變的IgG1-huCD3-H1L1-LFLEDA變體。表3抗體EC50(μg/mL)IgG1-huCD3-H1L1-LFLEDA0.096IgG1-huCD3-H1-LFLEDA-LF10L0.169IgG1-huCD3-H1-LFLEDA-LT41K0.096IgG1-huCD3-H1-LFLEDA-LK55N0.531IgG1-huCD3-H1-LFLEDA-LL97H0.095IgG1-huCD3-H1-LFLEDA-LLKNH0.438IgG1-CD3-hmAb286-LFLEDA0.397實施例15–雙特異性huCD3xHER2親和變體對T細胞的結合在Fc區具有或沒有LFLEDA突變的雙特異性(bs)IgG1-huCD3xHER2分子的純化的親和變體與自血沉棕黃層(供體號:N001814268806,購自Sanquin,Amsterdam,TheNetherlands)分離的人T細胞的結合通過FACS分析進行分析。按照制造商的說明書,將T細胞通過StemSepTM人T細胞富集試劑盒分離(StemCellTechnologies,Vancouver,Canada)。Herceptin-LbH1-突變從來自Bostrom等(85,86)的公開數據庫鑒定,和與Herceptin(曲妥單抗)相比,對HER2具有較低的親和力。為評價結合,將分離的T細胞(1x105細胞/孔)在聚苯乙烯96-孔圓底板(Greinerbio-one650101)中用在100μLPBS/0.1%BSA/0.02%疊氮化物中連續稀釋的抗體制備物(范圍6.4-10,000ng/mL,按5倍稀釋)在4℃孵育30分鐘。用PBS/0.1%BSA/0.02%疊氮化物洗滌兩次后,將T細胞以50μL用第二抗體在4℃孵育30分鐘。作為第二抗體,按1/200在PBS/0.1%BSA/0.02%疊氮化物中稀釋的R-藻紅蛋白(PE)-綴合的山羊-抗-人IgGF(ab’)2(JacksonImmunoResearchLaboratories,Inc.,WestGrove,PA)用于所有實驗。接著,T細胞用PBS/0.1%BSA/0.02%疊氮化物洗滌兩次,重懸于100μLPBS/0.1%BSA/0.02%疊氮化物中和在FACSCantoll(BDBiosciences)上分析。使用非線性回歸(S形劑量反應,具有可變斜率)使用GraphPadPrismV5.04軟件(GraphPadSoftware,SanDiego,CA,USA)分析結合曲線。結合曲線結果顯示于圖22,和EC50值顯示于表4。如所見到的,CD3變體的EC50值之間的最大差異是2倍。表4抗體EC50(μg/mL)bsIgG1-huCD3-H1L1/Herceptin-LFLEDA~0.40bsIgG1-huCD3-H1L1/Herceptin-LbH1-LFLEDA~0.28bsIgG1-huCD3-H1L1/HER2-LFLEDA0.26bsIgG1-huCD3-H1L1-LK55N/Herceptin-LFLEDA~0.44bsIgG1-huCD3-H1L1-LK55N/Herceptin-LbH1-LFLEDA0.40bsIgG1-huCD3-H1L1-LK55N/HER2-LFLEDA0.61bsIgG1-huCD3-hmAb286/Herceptin-LFLEDA0.53bsIgG1-huCD3-hmAb286/Herceptin-LbH1-LFLEDA0.68bsIgG1-huCD3-hmAb286/HER2-LFLEDA0.46實施例16-通過huCD3抗體親和變體誘導的體外T細胞介導的細胞毒性在本實施例中,針對HER2-陽性腫瘤細胞的T細胞介導的細胞毒性使用針對huCD3和HER2具有不同親和力的雙特異性抗體評價。雙特異性抗體按上文所述制備,和在CD3臂中包含F405L突變,和在HER2臂中包含K409R突變。具有不同的HER2表達水平的A431和AU565(人乳腺癌)細胞用于本測定法。HER2拷貝數對于A431細胞為~20,000和對于AU565細胞為~1,000,000。AU565細胞在補充10%(vol/vol)含鐵牛血清(LifeTechnologies,Germany)、1.5g/L碳酸氫鈉(Lonza,Germany)、1mM丙酮酸鈉(Lonza,Germany)、4.5g/L葡萄糖(Sigma)、50IU/mL青霉素和50μg/mL鏈霉素(Lonza,Basel,Switzerland)并具有HEPES和L-谷氨酰胺的RPMI1640(Lonza,BaselSwitzerland)中培養。A431(ATCC,表皮樣癌)細胞在補充10%(vol/vol)含鐵牛血清(LifeTechnologies,Germany)、50IU/mL青霉素和50μg/mL鏈霉素(Lonza,Basel,Switzerland)并具有HEPES和L-谷氨酰胺的RPMI1640(Lonza,Basel,Switzerland)中培養。將細胞系維持在37℃在5%(vol/vol)CO2潮濕孵育器中。AU565和A431細胞培養至接近匯合,之后細胞經受胰蛋白酶處理,重懸于培養基和通過細胞過濾器以獲得單細胞懸液。將AU565和A431細胞分別以3x104和1.6x104細胞/孔接種至96-孔培養板,和在37℃,5%CO2孵育至少3小時以允許附著至板上。人T細胞自血沉棕黃層分離,如實施例15中所述。分離的T細胞用PBS洗滌,重懸于培養基(RPMI1640,10%血清)和在96-孔板中按1:3比率加入至AU565或按1:10比例加入至A431細胞。稀釋系列(終濃度范圍0.1直至10,000ng/mL)的雙特異性抗體變體bsIgG1-huCD3/Herceptin-LFLEDA、bsIgG1-huCD3/Herceptin-LbH1—LFLEDA、bsIgG1-huCD3-H1L1/HER2-LFLEDA、bisIgG1-huCD3-LK55N/Herceptin-LbH1—LFLEDA、bsIgG1-huCD3-LK55N/HER2-LFLEDA、bsIgG1-huCD3-hmAb286/Herceptin-LFLEDA、bsIgG1-huCD3-hmAb286/Herceptin-LbH1—LFLEDA、bsIgG1-CD3-hmAb286/HER2-LFLEDA和bsIgG1-huCD3-H1L1/b12-LFLEDA在培養基中制備,和加入板中。將板在37℃,5%CO2孵育3天。細胞用1μM星孢素(Sigma)孵育,用作100%腫瘤細胞殺死的參考。將板用PBS洗滌兩次,和將包含10%Alamarblue(LifeTechnologies,Germany)的150μL培養基加入至各孔。將板在37℃,5%CO2孵育4小時。測量590nm的吸光度(Envision,PerkinElmer,Waltham,MA)。圖23顯示用CD3和HER2親和變體處理的A431細胞(圖23A)和AU565細胞(圖23B)的成活力。較低的HER2親和力組合高和低的CD3親和力在兩個細胞系中導致較低的功效(在兩個圖中作為開符號顯示)。對HER2具有類似的高親和力的雙特異性抗體(Herceptin和HER2)組合野生型huCD3-H1L1、huCD3-LK55N或CD3-hmAb286CD3臂顯示對A431細胞的類似功效。CD3臂的親和力變化對A431細胞的功效沒有影響。對HER2具有類似的高親和力的雙特異性抗體(Herceptin和HER2)組合CD3-hmAb286CD3臂、huCD3-LK55N臂和野生型huCD3-H1L1臂,顯示對AU565細胞的類似功效,對于CD3hmAb286CD3臂,顯示相對更高的功效。對CD3臂而言,較低的結合親和力在與A431細胞相比具有較高的HER2表達的AU565細胞中更加有利。實施例17–在NOD-SCID小鼠中huCD3-H1L1xHER2-LFLEDA和huCD3-H1L1xCD20-LFLEDA的體內腫瘤殺死作用雙特異性CD3xHER2抗體bsIgG1-huCD3-H1L1xHER2-LFLEDA的體內抗-腫瘤功效在皮下NCI-N87異種移植物模型中評價。在該模型中,人未受激的PBMC作為人T細胞的來源,與腫瘤細胞共接種,類似于Brischwein等(Mol.Immunol.43(2006),1129–1143)描述的模型。在這些實驗中,使用6-11周齡雌性NOD-SCID(NOD.CB17-Prkdcscid/NcrCrl)小鼠。來自健康供體的人PBMC自血沉棕黃層分離,如實施例15所述。在第0天,包含5x106細胞的PBMC和NCI-N87細胞兩者的混合物以200μL皮下接種至各小鼠的右脅。在注射的1小時內,將小鼠隨機指定為7個不同的治療組(n=4/供體)。各組靜脈內注射(i.v.)單劑量的(雙特異性)抗體。治療組顯示在表5中。使用測徑器(PLEXX)每周評價腫瘤生長兩次,直至終點腫瘤體積為1500mm3,直到腫瘤顯示潰瘍或直到研究結束。結果顯示在圖24中。如從圖24A中可見的,huCD3-H1L1xHER2-LFLEDA在所有三個測試濃度下有效地減少腫瘤大小。圖24B顯示腫瘤接種后29天的腫瘤大小。與PBS對照組相比,在用劑量0.05mg/kg、0.5mg/kg和5mg/kg的bsIgG1-huCD3-H1L1xHER2-LFLEDA治療的小鼠中腫瘤形成受到顯著抑制(p<0.0001,Tukeys多重比較檢驗),而用0.005mg/kg治療不影響腫瘤形成。用5mg/kg的對照抗體bsIgG1-huCD3-H1L1xb12-LFLEDA治療不抑制腫瘤形成,而用bsIgG1-b12xHER2-LFLEDA治療與PBS對照相比似乎誘導一定的腫瘤生長抑制,但根據單向Anova,Tukey’s多重比較檢驗,這不具有顯著性。表5組抗體劑量1PBS2bsIgG1-huCD3-H1L1xHER2-LFLEDA0.1μg(=0.005mg/kg)3bsIgG1-huCD3-H1L1xHER2-LFLEDA1μg(=0.05mg/kg)4bsIgG1-huCD3-H1L1xHER2-LFLEDA10μg(=0.5mg/kg)5bsIgG1-huCD3-H1L1xHER2-LFLEDA100μg(=5mg/kg)6bsIgG1-huCD3-H1L1xb12-LFLEDA100μg(=5mg/kg)7bsIgG1-b12xHER2-LFLEDA100μg(=5mg/kg)雙特異性CD20xCD3抗體huCD3-H1L1xCD20-LFLEDA的體內抗-腫瘤功效在皮下Raji異種移植物模型中評價。在該模型中,人未受激的PBMC作為人T細胞的來源,與腫瘤細胞共接種,類似于Brischwein等(Mol.Immunol.43(2006),1129–1143)描述的模型。使用6-11周齡的雌性NOD-SCID(NOD.CB17-Prkdcscid/NcrCrl)小鼠。來自健康供體的人PBMC自血沉棕黃層分離,洗滌和重懸于PBS-0.1%BSA。在第0天,包含5x106細胞的PBMC和Raji細胞兩者的混合物以200μL皮下接種至各小鼠的右脅。在注射的1小時內,將小鼠分選至7個組(n=4/供體)和各組靜脈內注射(i.v.)單劑量的(雙特異性)抗體。治療組顯示在表6中。使用測徑器(PLEXX)每周評價腫瘤生長兩次,直到終點腫瘤體積1500mm3,直到腫瘤顯示潰瘍或直到研究結束。結果顯示在圖25中。如從圖25A中可見的,在huCD3-H1L1xCD20-LFLEDA的兩個較高的測試劑量下(0.5mg/kg和0.05mg/kg),huCD3-H1L1xCD20-LFLEDA有效地減少腫瘤大小。在圖25B中,在各組是完整的最后一天(第21天)指示個體小鼠的腫瘤大小。與PBS對照組相比,在用劑量0.05mg/kg和0.5mg/kg的huCD3-H1L1xCD20-LFLEDA治療的小鼠中,腫瘤形成受到顯著抑制(p-值分別是p<0.05和p<0.01,用單向Anova,Tukey’s多重比較檢驗評價)。用0.005mg/kg治療不影響腫瘤形成。與PBS對照相比,用0.5mg/kg和0.05的對照抗體b12xCD20(bsIgG1-b12xCD20-LFLEDA)治療不顯著抑制腫瘤形成(單向Anova,Tukey’s多重比較檢驗)。表6組抗體劑量1PBS2bsIgG1-huCD3-H1L1xCD20-LFLEDA0.1μg(=0.005mg/kg)3bsIgG1-huCD3-H1L1xCD20-LFLEDA1μg(=0.05mg/kg)4bsIgG1-huCD3-H1L1xCD20-LFLEDA10μg(=0.5mg/kg)5bsIgG1-b12xCD20-LFLEDA1μg(=0.05mg/kg)6bsIgG1-b12xCD20-LFLEDA10μg(=0.5mg/kg)參考文獻列表[1]Xu等,2000,CellImmunol.200(1):16-26[2]Herold等,2005,Diabetes,54(6):1763-9[3]Staerz等,1985,Nature314:628-631[4]Muller和Kontermann,2010,BioDrugs24:89-98[5]Lum和Thakur,2011,BioDrugs25:365-379[6]Linke等,2010,MAbs2:129-136[7]Ruf等,2010,BrJClinPharmacol69:617-625[8]Bokemeyer等,2009,JClinOncol(MeetingAbstracts),3036[9]Heiss等,2010,IntJCancer127:2209-2221[10]Jones等,2009,LancetOncol10:1179-1187[11]Kiewe等,2006,ClinCancerRes12:3085-3091[12]WO2012/162067[13]WO2008/119567[14]FundamentalImmunologyCh.7,Paul,W編輯,第二版.RavenPress,N.Y.(1989)[15]LefrancMP,等,2003,DevCompImmunol.Jan;27(1):55-77[16]Brochet,X.等,2008,Nucl.AcidsRes.36,W503-508[17]Giudicelli,V.,Brochet,X,Lefranc,M.-P.,2011,ColdSpringHarbProtoc.Jun1;2011(6)[18]Sambrook等,1989,MolecularCloning:AlaboratoryManual,NewYork:ColdSpringHarborLaboratoryPress,Ch.15[19]WO92/22653[20]EP0629240[21]E.Meyers和W.Miller,1988,Comput.Appl.Biosci4,11-17[22]Needleman和Wunsch,1970,J.Mol.Biol.48,444-453[23]ClustalWalgorithm,Thompson,1994[24]T細胞表位數據庫,來自例如http://www.iedb.org/[25]Perry等,2008DrugsRD9(6):385-396[26]Bryson等,2010,Biodrugs24(1):1-8[27]Kabat,E.A.等,1991,Sequenceofproteinsofimmunologicalinterest.第5版-USDepartmentofHealthandHumanServices,NIHpublicationNo.91-3242,pp662,680,689[28]Oganesyan等,2008,ActaCryst.(D64):700-4[29]Canfield等,1991,J.Exp.Med.(173):1483-91[30]Duncan等,1988,Nature(332):738-40[31]Shields等,2001,J.Biol.Chem.(276):6591-604[32]IdusogieEE,等,2000,JImmunol.164:4178-84[33]Leabman等,2013,MAbs;5(6):896-903[34]Parren等,1992,J.ClinInvest.90:1537-1546[35]Bruhns等,.2009,Blood113:3716-3725[36]WO2011/066501[37]Lightle,S.,等,2010,ProteinScience(19):753-62[38]Brekke等,2006,JImmunol177:1129-1138[39]Dall’AcquaWF,等,2006,JImmunol177:1129-1138[40]Wu等,2010,GenerationandCharacterizationofaDualVariableDomainImmunoglobulin(DVD-Ig?)Molecule,In:AntibodyEngineering,SpringerBerlinHeidelberg[41]WO2011/131746[42]WO2002/020039[43]WO98/050431[44]WO2011/117329[45]EP1870459[46]WO2009/089004[47]US201000155133[48]WO2010/129304[49]WO2007/110205[50]WO2010/015792[51]WO2011/143545[52]WO2012/058768[53]WO2011/028952[54]WO2008/003116[55]US7,262,028[56]US7,612,181[57]WO2010/0226923[58]US7,951,918[59]CN102250246[60]WO2012/025525[61]WO2012/025530[62]WO2008/157379[63]WO2010/080538[64]Sykes和Johnston,1997,NatBiotech17,355-59[65]US6,077,835[66]WO2000/70087[67]Schakowski等,2001,MolTher3,793-800[68]WO2000/46147[69]Benvenisty和Reshef,1986,PNASUSA83,9551-55[70]Wigler等,1978,Cell14,725[71]Coraro和Pearson,1981,SomaticCellGenetics7,603[72]US5,589,466[73]US5,973,972[74]VanHeeke&Schuster,1989,JBiolChem264,5503-5509[75]F.Ausubel等,1987,ed.CurrentProtocolsinMolecularBiology,GreenePublishingandWileyInterScienceNewYork[76]Grant等,1987,MethodsinEnzymol153,516-544[77]Remington:TheScienceandPracticeofPharmacy,第19版,Gennaro編輯,MackPublishingCo.,Easton,PA,1995[78]SustainedandControlledReleaseDrugDeliverySystems,J.R.Robinson編輯,MarcelDekker,Inc.,NewYork,1978[79]Srivastava(編輯),RadiolabeledMonoclonalAntibodyForImagingandTherapy,PlenumPress1988[80]Chase,"MedicalApplicationsofRadioisotopes,"inRemington'sPharmaceuticalSciences,第18版,Gennaro等(編輯),pp.624-652,MackPublishingCo.,1990[81]Brown,"ClinicalUseofMonoclonalAntibodies,"inBiotechnologyandPharmacy227-49,Pezzuto等(編輯),Chapman&Hall1993[82]US5,057,313[83]US6,331,175[84]RitterG等;2001,CancerRes.,61:6851-9[85]Bostrom等,Science.2009;323(5921):1610-4[86]Bostrom等,PLosOne.2011;6(4)e17887。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1