一種重組全人源抗CTLA-4單克隆抗體制劑及其應用的制作方法
本發明屬于生物制藥領域,涉及一種重組全人源抗細胞毒性T淋巴細胞相關抗原4(CTLA-4)單克隆抗體制劑及其應用。
背景技術:
CTLA-4與CD28分子在基因結構、染色體定位、序列的同源性及基因表達上具有十分相近的關系,都是共刺激分子B7的受體,主要表達于被激活的T細胞表面。但是作為淋巴細胞激活的共刺激信號,CTLA-4與CD28分子的功能是相反的,在正常情況下,T細胞的激活依賴于第一信號(抗原抗體復合物的形成)和第二信號(B7介導的活化信號)雙活化。而CTLA-4與B7結合將產生抑制性信號并抑制T細胞活化。作為CTLA-4阻斷劑的單克隆抗體(CTLA-4mAb),可以特異地解除CTLA-4對機體的免疫抑制,激活T細胞,在抗腫瘤及寄生蟲等疾病的基因治療中有廣泛的應用前景。
IBI310(伊匹單抗仿制藥)就是根據以上機理設計研發的大分子單抗藥物。它是一種重組全人源抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體,是上市藥物YERVOY(ipilimumab)的仿制藥,其給藥途徑設計為靜脈滴注,劑量預計為3mg/kg。伊匹單抗(ipilimumab)的制劑組分包括:DTPA(二乙基三胺五乙酸)、甘露醇、氯化鈉、Tris-HCl(三羥甲基氨基甲烷鹽酸鹽)、PS80(聚山梨酯80),pH值為7.0。該制劑化學穩定性不高,產品容易發生化學降解反應。這些變化可能會對最終產品的安全性和有效性產生影響。因此,建立一個合適的制劑處方以保障產品的穩定性和安全性非常重要。IBI310作為伊匹單抗的仿制藥,由于其結構的復雜性,在非優化制劑中蛋白容易發生聚集且電荷變異體易于從堿性組分轉化為酸性組分。
單克隆抗體由于具有特異性強、半衰期長的優點,在藥物蛋白開發中逐漸受到重視。目前,單克隆抗體藥物是通過發酵生產的,主要在CHO細胞表達,在細胞培養、純化、制劑工藝及儲存過程中會發生糖基化、氧化、脫氨基以及聚集、降解、異構化,這些過程幾乎都會造成單克隆抗體的表面電荷的不均一性。單克隆抗體表面電荷的不均一性的變化會影響單克隆抗體的空間構象甚至造成生物活性的變化以及容易發生自我聚集。這些不利因素在將這類藥物制成穩定、安全、有效的制劑方面提出了巨大挑戰。
提高抗CTLA-4單克隆抗體制劑的物理化學穩定性,使電荷異構體的生成速率減慢,提高產品的質量均一性和一致性,延長產品的貨架期,提高其臨床使用穩定性是亟待解決的問題。
技術實現要素:
本發明所要解決的技術問題是提高抗CTLA-4單克隆抗體制劑的穩定性。
為了解決以上技術問題,本發明提供一種抗細胞毒性T淋巴細胞相關抗原4的組合物,該組合物由溶質和溶劑組成,所述溶質含有抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體、緩沖劑、滲透壓調節劑和螯合劑,所述溶劑為水。
上述組合物中,所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體在所述組合物中的濃度為2.5~7.5mg/ml,所述緩沖劑在所述組合物中的濃度為1.21~3.63mg/ml,所述滲透壓調節劑在所述組合物中的濃度為2.93~8.78mg/ml,所述螯合劑在所述組合物中的濃度為0.02~0.06mg/ml;pH為5.5~6.5;
所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體在所述組合物中的濃度優選為5.0mg/ml,所述緩沖劑在所述組合物中的濃度優選為2.42mg/ml,所述滲透壓調節劑在所述組合物中的濃度優選為5.85mg/ml,所述螯合劑在所述組合物中的濃度優選為0.04mg/ml。
上述組合物中,所述緩沖劑為枸櫞酸鈉或三羥甲基氨基甲烷;
所述滲透壓調節劑為氯化鈉;
所述螯合劑為乙二胺四乙酸二鈉。
上述任一所述的組合物中,所述組合物還包含蛋白保護劑;
所述蛋白保護劑在所述組合物中的濃度為5~15mg/ml,優選為10mg/ml。
上述組合物中,所述蛋白保護劑為甘露醇和/或精氨酸。
上述任一所述的組合物中,所述組合物還包含非離子型表面活性劑;
所述非離子型表面活性劑在所述組合物中的濃度為0.1-0.4mg/ml,優選為0.1mg/ml或0.4mg/ml。
上述組合物中,所述非離子型表面活性劑為聚山梨酯80和/或聚山梨酯20。
上述組合物中,所述溶質由所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體、所述緩沖劑、所述滲透壓調節劑、所述螯合劑,所述蛋白保護劑和所述非離子型表面活性劑組成;所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體在所述組合物中的濃度為2.5~7.5mg/ml,所述緩沖劑在所述組合物中的濃度為1.21~3.63mg/ml,所述滲透壓調節劑在所述組合物中的濃度為2.93~8.78mg/ml,所述螯合劑在所述組合物中的濃度為0.02~0.06mg/ml,所述蛋白保護劑在所述組合物中的濃度為5~15mg/ml,所述非離子型表面活性劑在所述組合物中的濃度為0.1-0.4mg/ml;所述組合物的pH為5.5~6.5。
上述組合物中,所述緩沖劑為枸櫞酸鈉或三羥甲基氨基甲烷;
所述滲透壓調節劑為氯化鈉;
所述螯合劑為乙二胺四乙酸二鈉;
所述蛋白保護劑為甘露醇和/或精氨酸;
所述非離子型表面活性劑為聚山梨酯80和/或聚山梨酯20。
上述任一所述的組合物中,所述抗細胞毒性T淋巴細胞相關抗原4 的單克隆抗體在所述組合物中的濃度為5.0mg/ml,所述枸櫞酸鈉在所述組合物中的濃度為2.42mg/ml,所述甘露醇在所述組合物中的濃度為10mg/ml,所述氯化鈉在所述組合物中的濃度為5.85mg/ml,所述乙二胺四乙酸二鈉在所述組合物中的濃度為0.04mg/ml,所述聚山梨酯80在所述組合物中的濃度為0.1mg/ml,pH為5.5。
上述任一所述的組合物中,所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體在所述組合物中的濃度為5.0mg/ml,所述三羥甲基氨基甲烷在所述組合物中的濃度為2.42mg/ml,所述精氨酸在所述組合物中的濃度為10mg/ml,所述氯化鈉在所述組合物中的濃度為5.85mg/ml,所述乙二胺四乙酸二鈉在所述組合物中的濃度為0.04mg/ml,所述聚山梨酯20在所述組合物中的濃度為0.4mg/ml,pH為6.5。
上述任一所述的組合物中,所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體的輕鏈可變區的CDR1、CDR2、CDR3序列分別如SEQ ID No.1的第46位至第57位、第73位至第79位、第112位至第120位所示,重鏈可變區的CDR1、CDR2、CDR3分別如SEQ ID No.2的第45位至第51位、第70位至第76位、第118位至第126位所示;
所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體的輕鏈可變區的氨基酸序列優選如SEQ ID No.1的第23位至第130位所示,重鏈可變區的氨基酸序列優選如SEQ ID No.2的第20位至第137位所示;
所述抗細胞毒性T淋巴細胞相關抗原4的單克隆抗體的輕鏈的氨基酸序列優選如SEQ ID No.1所示,重鏈的氨基酸序列優選如SEQ ID No.2所示。
為解決以上技術問題,本發明還提供上述任一所述的組合物在制備如下(1)-(6)任一所示的產品中的應用:
(1)抗細胞毒性T淋巴細胞相關抗原4的產品;
(2)解除細胞毒性T淋巴細胞相關抗原4對T淋巴細胞的活化的抑制的產品;
(3)解除細胞毒性T淋巴細胞相關抗原4對機體的免疫的抑制的產 品;
(4)激活T淋巴細胞的產品;
(5)預防和/或治療其中T淋巴細胞活性被抑制的疾病的產品;
(6)提高機體免疫水平的產品;
所述產品優選為制劑,再優選為靜脈滴注用制劑;
所述疾病優選為晚期轉移性惡性黑色素瘤。
本發明采用IBI310制備的重組全人源抗CTLA-4單克隆抗體制劑可作為靜脈滴注用制劑。并且,可將IBI310替換為其他抗CTLA-4單克隆抗體(包括基因工程技術獲得的抗CTLA-4單克隆抗體)制備得到具有同樣穩定性的抗CTLA-4單克隆抗體制劑。
本發明所提供的重組全人源抗CTLA-4單克隆抗體制劑可以使其所含有的抗CTLA-4單克隆抗體在常規存儲條件下穩定保存,并且即使在高溫加速條件下也具有提高的穩定性,該制劑具有較長的保質期,可以增加其臨床應用的安全性。
附圖說明
圖1為Protein A親和純化后目的蛋白的SDS-PAGE檢測結果。
圖2為Protein A親和純化后目的蛋白的CEX-HPLC檢測結果。
圖3為Protein A親和純化后目的蛋白的SEC-HPLC檢測結果。
圖4為伊匹單抗的親和力檢測結果。
圖5為56B3-29F6的收獲液經Protein A親和純化得到的目的蛋白的親和力檢測結果。
圖6為IBI310重鏈測序片段經DNASTAR-Seqman軟件拼接的結果。
圖7為IBI310輕鏈測序片段經DNASTAR-Seqman軟件拼接的結果。
具體實施方式
下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。
下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
以下結合具體實施例,對本發明作進一步說明。應理解,以下實施例僅用于說明本發明而非用于限定本發明的范圍。
下述實施例中所采用的還原型SDS-PAGE方法如下:按《中華人民共和國藥典》(2010年版,三部)附錄ⅣC,采用還原型SDS-PAGE凝膠電泳檢測純度,面積歸一化法計算樣品純度。
下述實施例中所采用的電荷變異體檢測(CEX-HPLC)方法如下:按照《中華人民共和國藥典》(2010年版,三部)附錄ⅢB進行測定,用弱陽離子分析柱對樣品進行檢測,面積歸一化法計算樣品酸、堿和主成分純度。
下述實施例中所采用的分子排阻色譜(SEC-HPLC)方法如下:按照《中華人民共和國藥典》(2010年版,三部)附錄ⅢB進行測定,用親水硅膠體積排阻色譜柱對樣品進行檢測,用面積歸一化法計算樣品純度。
下述實施例中的伊匹單抗處方制劑的原研藥為YERVOY(ipilimumab)Injection,Bristol-Myers Squibb公司,Application No.:125377;Approval Date:3/25/2011,下述實施例中采用的伊匹單抗為該原研藥;其仿制藥為重組全人源抗CTLA-4單克隆抗體注射液(簡稱IBI310),信達生物制藥(蘇州)有限公司產品,產品批號為3D74403。
中國倉鼠卵巢細胞系S亞型(CHO-S)為Invitrogen公司產品,產品目錄號為A13696-1。
CD FortiCHO為Invitrogen公司產品,產品目錄號為A11483-01。
Anti-Clumping Agent(防結塊劑)為Invitrogen公司產品,產品目錄號為0010057AE。
MTX(氨甲喋呤)為Calbiochem公司產品,產品目錄號為A6770。
Puro(嘌呤霉素)為Invitrogen公司產品,產品目錄號為A11138-03。
實施例1、抗CTLA-4單克隆抗體(IBI310)的制備
IBI310的氨基酸序列與伊匹單抗(Ipilimumab)的氨基酸序列相同。
一、載體構建
根據FreedomTMCHO-STMkit說明書,分別將IBI310的重鏈基因(SEQ ID No.4)和輕鏈基因(SEQ ID No.3)插入表達載體FreedomTMpCHO1.0(FreedomTMCHO-STMkit,GIBCO產品,產品目錄號為A13696-01)的第一個和第二個目的基因表達框架,構建成IBI310抗體表達質粒pCHO1.0-IHEKR。
二、表達質粒轉染宿主細胞
根據Free StyleTMpMAX Reagent說明書,通過Invitrogen化學轉染試劑(Free StyleTMpMAX Reagent,貨號:16447-100)將IBI310抗體表達質粒pCHO1.0-IHEKR轉入CHO-S宿主細胞中,完成轉染。
三、轉染后加壓篩選
將轉染48小時后的6瓶細胞懸液過濾后分別分裝至兩個方瓶中。使用含有Puro、MTX的篩選培養基(表1),在培養箱中靜置培養,7天后檢測細胞活率,根據細胞活率數值完成第一、二階段加壓篩選。
表1 培養基組分表
四、細胞群產量檢測
對第一和第二階段分別得到的12個細胞群采用6孔板5天靜置培養的方法進行高產細胞群的篩選。用Fortebio定量法檢測上清抗體表達量。該方法通過Protein A sensor檢測不同濃度的標準樣品,建立標準曲線來計算待測樣品的濃度,選取抗體表達量最高的細胞群YY 310-2 10/100-50/1000。
五、陽性單克隆篩選
利用有限稀釋法對選取的細胞群YY 310-2 10/100-50/1000進行單克隆。用克隆培養基(表1),經96孔板、6孔板兩個階段,進行高產克隆的篩選。根據6孔板篩選結果,將抗體表達量最高的12個克隆擴增培養并進行補糖實驗,獲得抗體表達量相對較高的細胞株56B3。
六、亞克隆細胞株的篩選
為保證構建主細胞庫所用細胞的單克隆性,對IBI310原始克隆細胞庫內的產量和穩定性均好的細胞株56B3進行了亞克隆。所用亞克隆方法同為有限稀釋法,經96孔板、6孔板兩個階段篩選出3個高產亞克隆:56B3-25D11、56B3-26D5和56B3-29F6,建立了由該3個亞克隆構成的原始亞克隆細胞庫。
七、確定最終生產用細胞株
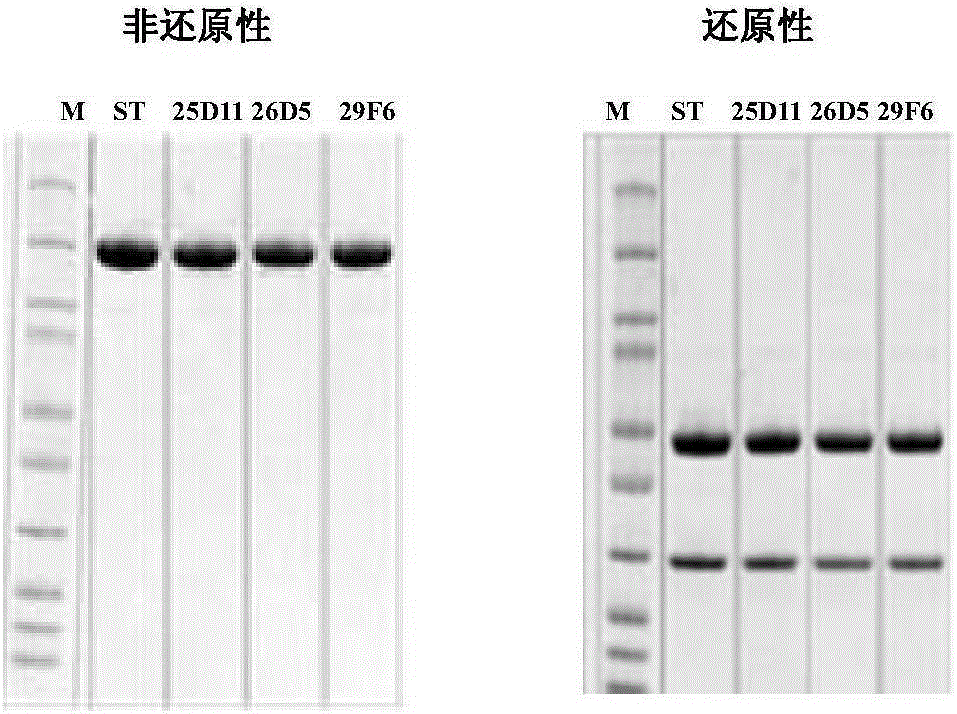
56B3-25D11、56B3-26D5和56B3-29F6三個亞克隆的收獲液經Protein A親和純化得到目的蛋白。以伊匹單抗為對照,采用SDS-PAGE法檢測,結果如圖1所示。
圖1中,M為蛋白Marker(NEB產品,貨號為P7703);ST:伊匹單抗;25D11、26D5和29F6分別代表56B3-25D11、56B3-26D5和56B3-29F6的收獲液經Protein A親和純化得到的目的蛋白。
圖1表明,56B3-25D11、56B3-26D5和56B3-29F6亞克隆細胞株所表達的目的蛋白的相對分子量大小和純度與伊匹單抗一致。
以伊匹單抗為對照,CEX-HPLC法檢測各亞克隆的收獲液經Protein A親和純化得到的目的蛋白的電荷異構,結果如圖2所示。
圖2中,亞克隆25D11、26D5和29F6分別代表56B3-25D11、56B3-26D5和56B3-29F6的收獲液經Protein A親和純化得到的目的蛋白。
圖2表明,56B3-25D11、56B3-26D5和56B3-29F6亞克隆細胞株所表達的目的蛋白與伊匹單抗相比,主峰一致。
以伊匹單抗為對照,SEC-HPLC法檢測各亞克隆的收獲液經Protein A親和純化得到的目的蛋白的純度,結果如圖3所示。
圖3中,亞克隆25D11、26D5和29F6分別代表56B3-25D11、56B3-26D5和56B3-29F6的收獲液經Protein A親和純化得到的目的蛋白。
圖3表明,56B3-25D11、56B3-26D5和56B3-29F6亞克隆細胞株所表達的目的蛋白的保留時間與伊匹單抗一致,純度均較高。
以伊匹單抗為對照,對56B3-29F6的收獲液經Protein A親和純化得到的目的蛋白進行親和力檢測,結果如圖4和圖5所示。
圖4和圖5表明,亞克隆56B3-29F6表達的目的蛋白的親和力與伊匹單抗相近。
對56B3-25D11、56B3-26D5和56B3-29F6這3個亞克隆細胞株進行60天穩定性檢測,結果顯示:56B3-29F6細胞株抗體產量無降低,56B3-25D11和56B3-26D5兩個細胞株的抗體產量有所降低。最終選定56B3-29F6為IBI310亞克隆。
八、原始細胞株的鑒定
對原始細胞株56B3-29F6進行基因組內目的基因測序,表達產物鑒定,質譜確定分子量。對重鏈和輕鏈采用PCR產物測序的方法。
IBI310重鏈測序片段經DNASTAR-Seqman軟件拼接后(如圖6所示),得到基因序列HC Seqman,該序列與伊匹單抗重鏈目的基因的理論序列進行Blast對比,結果表明二者完全一致。
IBI310輕鏈測序片段經DNASTAR-Seqman軟件拼接后(如圖7所示),得到基因序列LC Seqman,該序列與伊匹單抗輕鏈目的基因的理論序列進行Blast對比,結果表明二者完全一致。
九、細胞表達產物的鑒定
細胞株56B3-29F6進行搖瓶流加培養14天。收獲液經Protein A親和純化后進行通過液相色譜-質譜聯用檢測樣品的分子量,IBI310的分子量和伊匹單抗的分子量完全相同,如表2所示。
表2 伊匹單抗與IBI310分子量對比
抗CTLA-4單克隆抗體(IBI310)由2條輕鏈和2條重鏈組成,一條輕鏈和一條重鏈之間均通過二硫鍵連接,重鏈和重鏈之間通過二硫鍵連接;輕鏈的氨基酸序列如SEQ ID No.1所示,重鏈的氨基酸序列如SEQ ID No.2所示;輕鏈可變區的氨基酸序列如SEQ ID No.1的第23位至第130位所示,重鏈可變區的氨基酸序列如SEQ ID No.2的第20位至第137位所示;輕鏈可變區的CDR1、CDR2、CDR3序列分別如SEQ ID No.1的第46位至第57位、第73位至第79位、第112位至第120位所示,重鏈可變區的CDR1、CDR2、CDR3分別如SEQ ID No.2的第45位至第51位、第70位至第76位、第118位至第126位所示。
該單克隆抗體的輕鏈的編碼基因序列如SEQ ID No.3所示,重鏈的編碼基因序列如SEQ ID No.4所示;輕鏈可變區的編碼基因序列如SEQ ID No.3的第67位至第390位所示,重鏈可變區的編碼基因序列如SEQ ID No.4的第58位至第411位所示;輕鏈可變區的CDR1、CDR2、CDR3的編碼基因序列分別如SEQ ID No.3的第136位至第171位、第217位至第237位、第334位至第360位所示,重鏈可變區的CDR1、CDR2、CDR3的編碼基因序列分別如SEQ ID No.4的第133位至第153位、第208位至第228位、第352位至第378位所示。
實施例2、抗CTLA-4單克隆抗體制劑A
抗CTLA-4單克隆抗體制劑A的組成如下:該制劑由溶質和溶劑組成,溶質為實施例1制備的抗CTLA-4單克隆抗體(IBI310)、枸櫞酸鈉、甘露醇、氯化鈉、EDTA-2Na(乙二胺四乙酸二鈉)和聚山梨酯80,溶劑為注射用水;抗CTLA-4單克隆抗體(IBI310)在抗CTLA-4單克隆抗體制劑A中的濃度為5mg/ml,枸櫞酸鈉在抗CTLA-4單克隆抗體制劑A中的濃度為2.42mg/ml,甘露醇在抗CTLA-4單克隆抗體制劑A中的濃 度為10mg/ml,氯化鈉在抗CTLA-4單克隆抗體制劑A中的濃度為5.85mg/ml,EDTA-2Na在抗CTLA-4單克隆抗體制劑A中的濃度為0.04mg/ml,聚山梨酯80在抗CTLA-4單克隆抗體制劑A中的濃度為0.1mg/ml;pH為5.5。
在配制抗CTLA-4單克隆抗體制劑A時,溶質中非離子型表面活性劑聚山梨酯80最后加入再進行定容,其他溶質的添加則無先后順序。
將抗CTLA-4單克隆抗體制劑A無菌分裝至西林瓶中,加蓋橡膠塞和鋁塑蓋,獲得該制劑的成品。
實施例3、抗CTLA-4單克隆抗體制劑B
抗CTLA-4單克隆抗體制劑B的組成如下:該制劑由溶質和溶劑組成,溶質為實施例1制備的抗CTLA-4單克隆抗體(IBI310)、三羥甲基氨基甲烷(Tris)、精氨酸、氯化鈉、EDTA-2Na(乙二胺四乙酸二鈉)和聚山梨酯20,溶劑為注射用水;抗CTLA-4單克隆抗體(IBI310)在抗CTLA-4單克隆抗體制劑B中的濃度為5mg/ml,三羥甲基氨基甲烷在抗CTLA-4單克隆抗體制劑B中的濃度為2.42mg/ml,精氨酸在抗CTLA-4單克隆抗體制劑B中的濃度為10mg/ml,氯化鈉在抗CTLA-4單克隆抗體制劑B中的濃度為5.85mg/ml,EDTA-2Na在抗CTLA-4單克隆抗體制劑B中的濃度為0.04mg/ml,聚山梨酯20在抗CTLA-4單克隆抗體制劑B中的濃度為0.4mg/ml;pH為6.5。
在配制抗CTLA-4單克隆抗體制劑B時,溶質中非離子型表面活性劑聚山梨酯20最后加入再進行定容,其他溶質的添加則無先后順序。
將抗CTLA-4單克隆抗體制劑B無菌分裝至西林瓶中,加蓋橡膠塞和鋁塑蓋,獲得該制劑的成品。
實施例4、抗CTLA-4單克隆抗體制劑A和抗CTLA-4單克隆抗體制劑B的加速穩定性實驗
對實施例2和3制備的抗CTLA-4單克隆抗體制劑進行加速穩定性實驗,以酸性組分、堿性組分和主成分的百分含量的變化和蛋白純度的主峰含量作為判定手段,分別通過電荷變異體(CEX-HPLC檢測)和蛋白純度(SDS-PAGE檢測)表征制劑中抗CTLA-4單克隆抗體的化學穩定性。
采用電荷變異體檢測(CEX-HPLC)方法和還原型SDS-PAGE方法分析實施例2制備的抗CTLA-4單克隆抗體制劑A、實施例3制備的抗CTLA-4單克隆抗體制劑B以及伊匹單抗在37±2℃高溫加速條件下下貯存0h和1個月的蛋白電荷變異體含量的變化以及蛋白純度的變化,結果分別如表3和表4所示。
表3 37±2℃蛋白電荷變異體比較結果
表4 37±2℃蛋白純度比較結果
IBI310的結構復雜,導致其化學性質不穩定,蛋白容易發生聚集且電荷變異體易于從堿性組分轉化為酸性組分。表3和表4的結果表明,抗CTLA-4單克隆抗體制劑A和B的電荷變異體含量的變化和蛋白純度的下降均顯著慢于伊匹單抗處方制劑。
同時經過觀察發現,抗CTLA-4單克隆抗體制劑A和B的其他穩定性指標如外觀、蛋白濃度、濁度等在該加速條件下均與伊匹單抗處方制劑相當。
以上結果表明,本發明的實施例2和3分別制備的抗CTLA-4單克隆抗體制劑A和B可以使其中所含有的重組全人源抗CTLA-4單克隆抗體的化學降解速率降低,提高重組全人源抗CTLA-4單克隆抗體的物理化學穩定性,使得該單克隆抗體能穩定存在于制劑處方中。與現有的抗CTLA-4單克隆抗體制劑相比,本發明所制備的抗CTLA-4單克隆抗體制劑具有提高的產品質量均一性和一致性以及延長的產品貨架期,穩定性高,可以增加其臨床的安全性。
- 還沒有人留言評論。精彩留言會獲得點贊!