一種克林霉素磷酸酯凍干粉針試劑的制作方法
本發明屬藥物制劑領域,涉及一種抗菌用的粉針試劑,具體涉及一種用于抗菌的克林霉素磷酸酯粉針試劑,該粉針試劑可被廣泛運用到治療革蘭式陽性細菌,厭氧細菌引起的各種感染。
背景技術:
:現有技術公開了克林霉素磷酸酯是克林霉素的衍生物,其化學名稱為:(2s-反式-6-(1-甲基-4-丙基-2-吡咯烷碳酰氨基)-1-硫代-甲基-7-氯-6,7,8-三脫氧-L-蘇式-α-D-半乳糖吡喃糖苷-2-二氫磷酸酯,在臨床上被廣泛用于治療革蘭式陽性細菌,厭氧細菌引起的各種感染。目前,治療所述的感染的試劑主要以粉針試劑的形式存在,實踐顯示,制成粉針試劑可以解決試劑的穩定性,但是溶解性能相對變差。現有技術中,在制備一些難溶性藥物,例如克林霉素磷酸酯藥物,由注射液變更為粉針劑時,常使用增溶劑、采用pH值調節以及分割原劑型規格制成小規格粉針劑等是常用的方法,其中,難溶性藥物制備為粉針劑時,增溶劑的使用是一種比較普遍的措施。目前,該
技術領域:
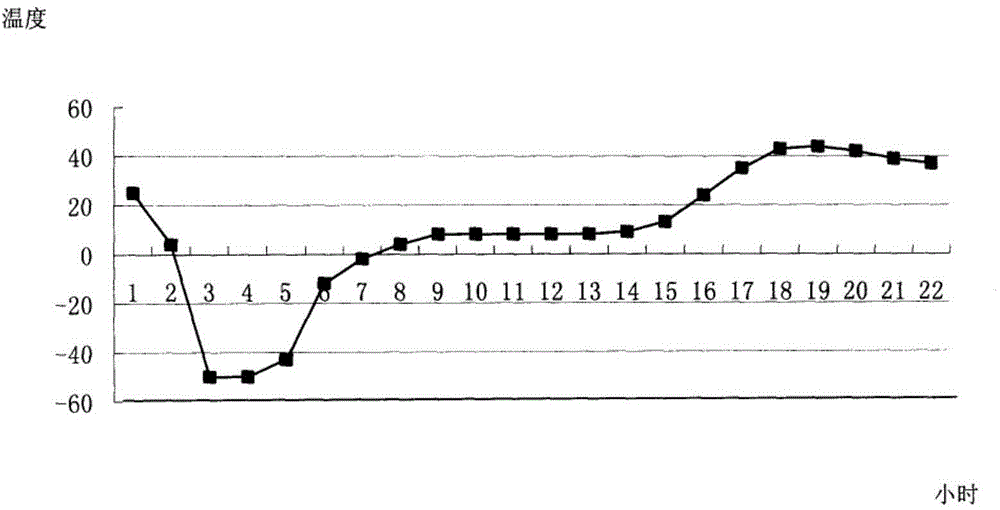
中使用較多的增溶劑主要有羥丙基-β-環糊精、PEG系列、聚山梨酯80(吐溫80)和泊洛沙姆等;中國發明專利01133218.2和101569612A公開了一種克林霉素磷酸酯粉針試劑和制備方法,其中均含有吐溫80為增溶劑,然而,實踐顯示,吐溫80具有的溶血風險會顯著影響藥物的安全性。針對目前上述產品制劑形式在實踐中存在的若干缺陷的現狀,本申請的發明人擬提供一種更加安全的凍干試劑及生產工藝,更具體涉及一種更加安全有效的增容的方法,同時不影響克林霉素磷酸酯的性能,并且不影響藥物的使用,即在使用過程中,不會因為溶解而出現混濁或結晶現象。技術實現要素:本發明目的在于克服現有技術的缺陷,提供一種新的克林霉素磷酸酯粉針試劑,該粉針試劑在凍干劑處方中添加適當比例的氯化鈉或苯甲酸鈉作為助溶劑, 在適當的pH條件下進行凍干,制得的克林霉素磷酸酯粉針試劑不具有溶血風險,顯著增加用藥的安全性,同時保證了藥品的質量。本發明目的通過如下技術方案實現:本發明的一種克林霉素磷酸酯凍干粉針試劑,包括克林霉素磷酸醋和助溶劑,其特征在于,所述克林霉素磷酸酯為1重量份;氯化鈉或苯甲酸鈉為0.05-3重量份;采用注射用水作凍干溶劑,碳酸氫鈉調節凍干溶液pH值為pH4-8。本發明的實施例中,優選克林霉素磷酸酯粉針試劑的組成為:克林霉素磷酸酯為為1重量份;苯甲酸鈉為0.05重量份;注射用水用作凍干溶劑,用10%碳酸氫鈉調節pH值為pH4-8;本發明的另一實施例中,優選克林霉素磷酸酯粉針試劑的組成為:克林霉素磷酸酯為1重量份;氯化鈉為0.05重量份;溶于注射用水中,用10%碳酸氫鈉調節pH值為pH6.0-6.5。本發明的另一實施例中,優選克林霉素磷酸酯粉針試劑的組成為:克林霉素磷酸酯為1重量份;氯化鈉為3重量份;溶于注射用水中,用10%碳酸氫鈉調節pH值為pH6.0-6.5。本發明目的進一步目的,還提供一種制備克林霉素磷酸酯粉針試劑的方法,其包括,先將氯化鈉溶于注射用水中,再加入克林霉素磷酸酯,再用10%碳酸氫鈉調節pH至6.0-6.5,無菌過濾,冷凍干燥;在本發明的一個實施例中優選:在過濾前,用0.1%-0.3%的活性炭對溶液進行處理,較優的,用活性炭對溶液進行處理的時間為30分鐘,較優的,所用克林霉素磷酸酯和氯化鈉質量份數比為20:1至1:3,更優的,調節pH為6.3和6.4。本發明的優點在于:本發明的粉針試劑在凍干劑處方中添加適當比例的氯化鈉或苯甲酸鈉作為助溶劑,在適當的pH條件下進行凍干,制得的克林霉素磷酸酯粉針試劑不含有具有溶血風險的增溶劑,因而不具有溶血風險,明顯降低藥物的安全風險,顯著增加用藥的安全性,同時保證藥品的質量;同時,所述的制備的方法能大大簡化生產過程,降低生產成本。為了便于理解,以下將通過具體的附圖和實施例對本發明進行詳細地描述。 需要特別指出的是,具體予試驗實例和附圖僅是為了說明,顯然本領域的普通技術人員可以根據本文說明,在本發明的范圍內對本發明做出各種各樣的修正和改變,這些修正和改變也納入本發明的范圍內。附圖說明圖1是本發明的克林霉素磷酸酯凍干粉針試劑的凍干曲線。具體實施方式實施例11)凍干溶媒選擇依據由于注射用水具有無毒、無生理活性、無生理刺激性、價廉易得等優點,因此選用注射用水作為本品凍干用溶媒;2)pH值確定取克林霉素磷酸酯,制成300毫克的克林霉素磷酸酯溶液,溶液的pH值為3.4,溶液呈混濁狀態,經10%碳酸氫鈉溶液調節pH值為5.5,6.0,6.5及7.0,考察其溶液的澄清度與顏色,結果表明,pH6.0時,主藥未完全溶解,為兼顧本品生理適應性及凍干過程對pH的影響,確定注射用克林霉素磷酸酯配制溶液的pH范圍為6.0-6.5(如表1所示);表1pH值的選擇pH值5.56.06.57.0溶液的澄清度與顏色渾濁澄清無色澄清無色澄清無色3)助溶劑的選擇雖然克林霉素磷酸酯在水中易溶,但為保證成品可見異物的合格,在所述配方中加入適量量的氯化鈉,按不同配方量準確稱取氯化鈉,倒入總體積60%的注射用水中,不斷攪拌至全部溶解;再加入16克林霉素磷酸酯,然后邊攪拌邊用10%碳酸氫鈉溶液調節pH值至6.0-6.5,初濾、精濾、灌裝后按凍干工藝凍干,觀察成品的pH值和可見異物,結果表明:通過加不同濃度的氯化鈉或苯甲酸鈉, 配方2、3、4和5的可見異物符合規定(如表2所示);表2助溶劑對注射用克林霉素磷酸酯的影響試驗4)灌裝液穩定性實驗按可見異物符合規定配方配制注射用克林霉素磷酸酯溶液,加入0.1%活性炭吸附脫色0.5小時,用微孔濾膜進行過濾,于0,1,2,3,4,5,6h時間點測定溶液濃度和可見異物,結果表明:注射用克林霉素磷酸酯灌裝液在6小時內含t穩定,異物符合規定要求(如表3所示);表3灌裝液的穩定性試驗結果時間點(h)0123456RSD可見異物合格合格合格合格合格合格合格_含量(mg/ml)145.65149.10145.261467.81147.16149.18140.380.435)高溫實驗取注射用克林霉素磷酸酯,60℃溫度下放置10天,于第5天和第10天取樣,考察性狀、酸度、有關物質、含量、可見異物,結果如表4所示;表4高溫(60℃)對注射用克林霉素磷酸酯穩定性的影響6)高濕度試驗將注射用克林霉素磷酸酯揭去鋁塑組合蓋和氮化藥用丁基橡膠塞,按吸濕性試驗方法,在相對濕度90%和75%條件下放置10天,于第5天和第10天取樣,按穩定性重點考察項目要求檢測,結果如表5所示;表5濕度對注射用克林霉素磷酸酯穩定性的影響7)光照試驗取注射用克林霉素磷酸酯,放在光照裝置內,于室溫和光照度為4500Lx士500Lx的條件下放置10天,于第5天和第10天取樣,按穩定性重點考察項目要求進行檢測,本品在60℃貯存條件下放置10天,各項指標均符合規定;結果顯 示,所述試驗品在25℃和90%相對濕度條件下貯存10天,凍干塊收縮,呈粘性透明狀物,吸濕增重明顯,溶液顏色和澄清度不符合規定,含量及有關物質符合規定;所述試驗品在25℃和75%相對濕度條件下放置10天,吸濕增重不明顯,其他各項指標均符合規定;結果表明,所述試驗品在強光照射條件下放置10天,各項指標均符合規定(如表6所示);表6光照(4500Lx±500Lx.)對注射用克林霉素磷酸酯穩定性的影響8)配伍試驗鑒于試驗產品將用于臨床靜脈滴注給藥,本實驗進一步考察試驗樣品與0.9%氯化鈉注射液和5%葡萄糖注射液的配伍穩定性,取0611批樣品2瓶,分別配制成6mg/ml的溶液,混勻,室溫放置,分別于0,1,2,3,4,6,8h觀察其溶液澄清度與顏色、pH值、含量、有關物質等變化,結果顯示:本試驗樣品與0.9%氯化鈉注射液,5%葡萄糖注射液配伍8小時穩定(如表7、表8所示);表7注射用克林霉素磷酸酯與0.9%氯化鈉注射液的配伍穩定性考察結果表8注射用克林霉素磷酸酯與5%葡萄糖注射液的配伍穩定性考察結果9)制備方法稱取配方量克林霉素磷酸酯和氯化鈉,在60%總體積的注射用水中加入配方量氯化鈉或苯甲酸鈉,攪拌使充分溶解,再加入配方量的克林霉素磷酸酯,邊攪拌邊用10%碳酸氫鈉調PH至6.0-6.5,再加注射用水至規定體積,加0.1%的針用活性炭,攪拌30分鐘,除菌過濾,濾液經檢驗合格后,按每瓶約2.5mL分裝于玻璃管制注射劑瓶中或粉液雙室袋的粉腔中,冷凍干燥,壓塞,軋蓋,包裝,即得;將制備的注射用克林霉素磷酸酯溶液定量分裝入7m1玻璃管制注射劑瓶,用氯化藥用丁基橡膠塞半加塞,放入凍干機箱內,開啟凍干機,采用程序控制設定凍干曲線(如圖1所示),凍干過程結束,自動壓塞;考察按上述凍干曲線制備的三批注射用克林霉素磷酸酯的外觀、水分、pH,結果表明:按設定的凍干曲線考察制備的三批產品,其外觀、水分和pH值均符合質量標準要求(如表9所示);表9同一凍干曲線下三批樣品考察結果批號外觀水分(%)pH050791為白色疏松狀物0.416.3050792為白色疏松狀物0.586.3050793為白色疏松狀物0.436.3本發明實驗中,根據國家食品藥品監督管理局制劑處方及工藝研究指導原則,進行了制劑處方和工藝的研究,結果表明,本發明的粉針試劑的配方可行,制備方法的工藝條件可以保證藥品質量。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1