細胞因子誘導的殺傷細胞的雙特異性抗體介導的癌癥治療的制作方法
發明領域
本公開涉及基于細胞的免疫治療和藥物相關的組合物和方法。本公開尤其涉及用于治療癌癥的治療法。
背景
基于細胞的免疫治療對于癌癥治療有很大的希望。然而,很難獲得大量可以有效靶向腫瘤細胞的抗腫瘤特異性效應物免疫細胞。細胞因子誘導的殺傷細胞(即cik)是細胞毒性免疫效應細胞,由于cik具有抗腫瘤細胞毒性和多樣的t細胞受體特異性而成為新一代抗腫瘤免疫細胞治療的強有力的候選物。
cik是來自離體或者體外擴增細胞的異質細胞群體。cik可以在可溶性因子,例如抗cd3抗體、ifn-γ和il-2的存在下在標準培養條件下產生。cik細胞可以同時表達t細胞標志物cd3和自然殺傷細胞(即nk)標志物cd56,并且具有t和/或nk細胞表型。基于cik的治療成為有希望的癌癥治療方法,主要因為cik擴增相對容易,并且cik具有不受主要組織相容性復合物(即mhc)限制的t和nk細胞的抗腫瘤活性。
然而,對于基于細胞的免疫治療存在已知的挑戰。基于細胞的免疫治療通常是劑量限制性的、時間限制性的、昂貴的、勞動密集型的,并且尚未轉化為常規的臨床應用。
因此,需要改進目前基于細胞的免疫治療以提供更有效率和效果的癌癥治療方法,該治療方法更容易制備、具有更好的臨床穩定性和功效以及降低的系統毒性。本公開通過提供顯著改善癌癥患者的治療和管理的新型組合物和方法解決了改進基于細胞的免疫治療的需要。
概述
本技術涉及一種組合物,其包含msbody和細胞毒性免疫細胞,其中所述msbody包含:a)對腫瘤抗原具有特異性的第一抗原結合部分,和b)與所述免疫細胞結合的第二抗原結合部分。
在一些實施方案中,所述細胞毒性免疫細胞是細胞因子誘導的殺傷(cik)細胞、t細胞、自然殺傷(nk)細胞、自然殺傷t細胞或者淋巴因子激活的殺傷(lak)細胞。在一些實施方案中,所述細胞是所述細胞因子誘導的殺傷(cik)細胞。在一些實施方案中,所述msbody與所述細胞因子誘導的殺傷(cik)細胞的細胞表面或者膜蛋白結合。
在一些實施方案中,所述蛋白質是cd3或者fc受體。在一些實施方案中,所述腫瘤抗原選自所述組,該組由egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72,cix、psma、葉酸結合蛋白、gd2、gd3、gm2、vegf、vegfr、整聯蛋白αvβ3、整聯蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白組成。
在一些實施方案中,所述cik細胞包含異質細胞群體。在一些實施方案中,所述異質細胞群體包含至少兩個細胞。在一些實施方案中,所述cik細胞是dc3+cd56+細胞。在一些實施方案中,所述cik細胞針對腫瘤細胞具有非mhc限制性細胞溶解活性。
在一個方面,本技術還提供了一種用于制備包含msbody和細胞毒性免疫細胞的組合物的方法。
在另一個方面,本技術進一步提供了一種治療包括癌癥患者的患者的方法,包括:a)從所述患者獲得外周血淋巴細胞(pbl)樣品;b)用抗cd3抗體、ifn-γ和il-2孵育pbl以獲得cik細胞;c)用雙特異性抗體武裝所述cik細胞,其中每個msbody包含對腫瘤抗原具有抗原結合特異性的第一抗原結合部分,和與所述cik細胞結合的第二抗原結合部分,和d)施用所述具有結合的雙特異性抗體武裝的cik細胞到有需要的患者。
在一個方面,本技術提供了一種包含組合物的試劑盒,所述組合物包含msbody和細胞毒性免疫細胞,其中所述msbody包含:a)對腫瘤抗原具有特異性的第一抗原結合部分,和b)與所述細胞結合的第二抗原結合部分,以及使用說明書。
附圖簡述
作為本公開的實施方案,提供的是僅通過示例而非限制說明的附圖,其中:
圖1描繪了雙特異性抗體(msbody)可以武裝在cik細胞上并且裂解腫瘤細胞。抗cd3特異性單鏈抗體可以由多種msbody抗體共享。靶抗原特異性單體抗體對于每一種msbody抗體是不同的,并且可以識別靶標,例如her2或者ep-cam。所有msbody可以在表達cd3的活化cik細胞的表面上武裝,以形成武裝活化cik細胞(acc)。如右圖所示,msbody抗體可以通過同時結合cd3和靶抗原來瞬時連接cik細胞和癌細胞,同時,抗體的fc部分可以結合免疫輔助細胞的fc受體。這觸發cik細胞和免疫輔助細胞活化,包括細胞毒性顆粒融合、瞬時細胞因子釋放和/或增殖。附著癌細胞的重定向裂解涉及穿孔素的膜穿孔以及由顆粒酶誘導的繼發性程序性細胞死亡。
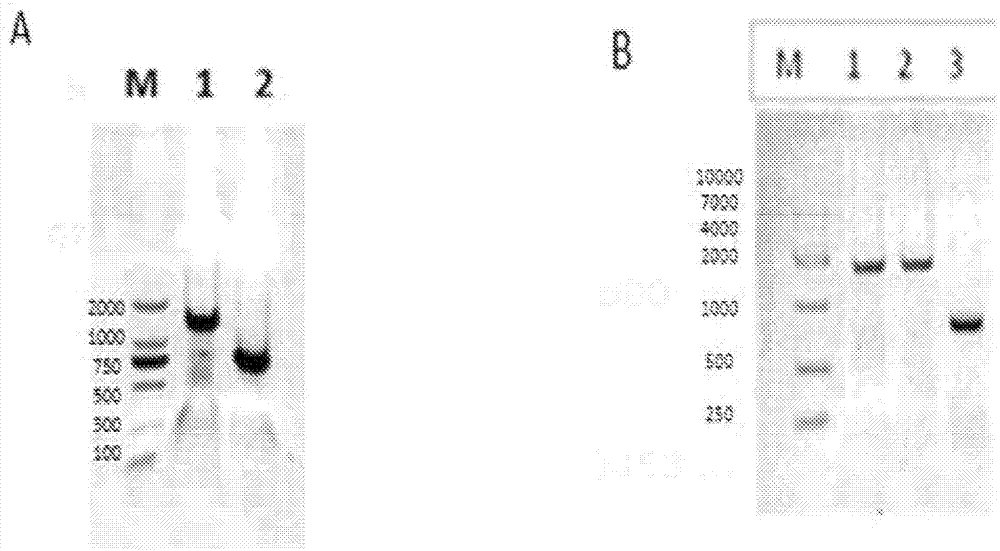
圖2描述了1%瓊脂糖凝膠電泳。a.泳道m:dl2000標志物;泳道1:抗-ep-camhc;泳道2:抗ep-camlc;b.泳道m:dl10000標志物;泳道1:赫賽汀hc;泳道2:l2k-scfv;泳道3:赫賽汀lc。
圖3描述了考馬斯藍染色的sds-page凝膠和通過hplc-sec檢測的雙特異性抗體的純度。a.考馬斯藍染色的還原的8%sds-page凝膠。b.考馬斯藍染色的未還原的6%sds-page凝膠(泳道m:蛋白標志物,泳道1.her2xcd3msbody,泳道2.ep-camxcd3msbody);c.純化的her2xcd3msbody;d.純化的ep-camxcd3msbody。
圖4描述了her2×cd3msbody與sk-br-3細胞(a)和jurkat(b)細胞表面結合的流式細胞分析;黑色實線:msbody和黑色虛線:赫賽汀或者l2k單克隆抗體。
圖5描述了ep-camxcd3msbody與sw480細胞(a)和jurkat(b)細胞表面結合的流式細胞分析;黑色實線:msbody和黑色虛線:抗-ep-cam單克隆抗體或者l2k單克隆抗體。
圖6是通過抗-cd45/cd3/cd56抗體的facs檢測cik細胞的表型。a.cd45陽性對照;b.cd3和cd56陰性對照;c.cd45陽性人群;d.右上象限顯示cd3和cd56雙陽性。
圖7描述了msbody分子介導的共結合分析。a.未經cfse或pkh26染色的sk-br-3和cik共結合陰性對照;b.經cfse和pkh26染色的sk-br-3和cik共結合對照,分別不加msbody;c.右上象限顯示與msbody共結合的兩種細胞。
圖8描述了msbody武裝活化cik細胞(acc)的特異性。通過流式細胞術測定具有從100nm至0.78nm一系列濃度的her2×cd3msbody武裝活化的cik細胞,pe標記的抗人iggfc。
圖9描述了武裝活化cik細胞(acc)裂解sk-br-3乳腺癌細胞。(■)her2×cd3msbody的系列稀釋液或者(●)100nmhigg。acc與sk-br-3靶細胞以e:t=5:1比例孵育,24小時后通過使用熒光染料cfse和pi的基于流式細胞檢測來測定細胞裂解。圖示來自一式三份測定的平均值。
圖10描述了her2×cd3msbody誘導的針對sk-br-3細胞的細胞毒性。24小時(a)或48小時(b)后測定細胞裂解,使用her2×cd3msbody(●)赫賽汀(■)higg(▼)的系列稀釋液引入細胞裂解,并且使用graphpadprism軟件測定ec50值和最大裂解。
圖11描述了ep-cam×cd3msbody誘導的針對sw480細胞的細胞毒性結果。24小時(a)或48小時(b)后測定細胞裂解,使用ep-cam×cd3msbody(■)抗-ep-cam單克隆抗體(▼)higg(○)的系列稀釋液引入細胞裂解,使用graphpadprism軟件測定ec50值和最大裂解。
圖12描述了武裝活化cik細胞(acc)可以抑制腫瘤生長,(●)無cik細胞和msbody(■)注射未武裝的cik細胞(▲)注射用her2×cd3msbody武裝的cik細胞。
附圖的部分或所有是用于示例的示意性表示;因此,它們不必描述所示元件的實際相對尺寸或者位置。提供附圖是出于說明一個或多個實施例的目的,明確理解它們將不用于限制以下權利要求的范圍或含義。
詳述
貫穿本公開,本文涉及本發明營養物、組合物和方法的多種實施方案。多種實施方案的描述旨在提供各種說明性示例而不應解釋為對替代物的描述。相反,應當注意,本文提供的多種實施方案的描述可以具有重疊的范圍。本文討論的實施方案僅僅是說明性的,并且不意味著限制本公開的范圍。
同樣貫穿本公開,多種出版物、專利和公開的專利說明書通過識別引文來引用。這些出版物、專利和公開的專利說明書公開的內容在此通過引用并入本公開中,以更全面地描述本公開所述領域的狀態。
定義
如在說明書和權利要求書中所用,單數形式“一”,“一個”和“所述”包括復數指代,除非上下文另有明確規定。例如,術語“電極”包括多個電極,包括其混合物。
如本文所使用的,術語“包含”旨在表示裝置和方法包括的組件或步驟,但不排除其他。“基本上由……組成”當用于限定裝置和方法時,應當意味著排除對該組合具有任何實質意義的其它組件或步驟。“由……組成”應當意味著排除其它組件或步驟。這些過渡術語中的每一個所限定的實施方案在本公開的范圍內。
所有數字名稱,例如距離、尺寸、溫度、時間、電壓和濃度,包括范圍,是以±0.1的增量變化的近似值。應當理解是,盡管不總是明確地指出,所有的數字標號前都有術語“約”。還應當理解是,盡管不總是明確說明,本文所描述的組件僅僅是示例性的并且這些組件的等效物在本領域是已知的。
“腫瘤抗原”是在腫瘤細胞中產生的抗原物質,即它在宿主中觸發免疫應答。腫瘤抗原可用于鑒定腫瘤細胞并且對用于癌癥治療是潛在的候選物。機體中的正常蛋白質不是抗原性的。然而,在腫瘤發生過程中,某些蛋白質產生或者過表達并因此對機體顯示“外源”。這可能包括與免疫系統良好隔離的正常蛋白質、通常以極小量產生的蛋白質、通常僅在某些發育階段產生的蛋白質或者其結構由于突變而修飾的蛋白質。
如本文所用,術語“細胞毒性免疫細胞”是指當用本公開的雙特異性抗體激活和武裝時,靶向并殺死腫瘤細胞或細胞系或被病原體感染的細胞的免疫系統的細胞。示例的細胞毒性免疫細胞包括但不限于cik細胞、t細胞、cd8+t細胞、活化的t細胞、單核細胞、自然殺傷(nk)細胞、nkt細胞、淋巴因子激活的殺傷(lak)細胞、巨噬細胞和樹突細胞。
如本文所用,術語“多肽”意在包括單個“多肽”以及多個“多肽”,并且是指由通過酰胺鍵(也稱為肽鍵)線性連接的單體(氨基酸)組成的分子。術語“多肽”是指兩個或者更多個氨基酸的任一條或多條鏈,而不是指特定長度的產物。因此,肽、二肽、三肽、寡肽、“蛋白質”、“氨基酸鏈”或用于指兩個或者更多個氨基酸的一條或多條鏈的任何其他術語包括在“多肽”的定義中,并且術語“多肽”可被這些術語的任一個替代或互換。術語“多肽”也意指多肽的表達后修飾的產物,包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通過已知的保護/封閉基團的衍生化、蛋白水解切割或者通過非天然發生的氨基酸產生的修飾。多肽可來自天然生物源或者通過重組技術產生,但不必從指定的核酸序列翻譯而來。其可以以任何方式產生,包括通過化學合成。
“同源性”或者“同一性”或者“相似性”是指兩個肽之間或兩個核酸分子之間的序列相似性。同源性可以通過比較每個序列中為了比較目的而可以比對的位置來確定。當比較序列中的位置被相同的堿基或氨基酸占據時,則分子在該位置是同源的。序列之間的同源性程度是由序列共享的匹配或者同源位置的數量的函數。盡管優選小于25%的同一性,“不相關”或者“非同源”序列與本公開的序列之一仍共享小于40%的同一性,。
多核苷酸或者多核苷酸區域(或者多肽或者多肽區域)與另一個序列的“序列同一性”具有一定百分比(例如60%、65%、70%、75%、80%、85%、90%、95%、98%或者99%),是指當比對時,在比較兩個序列時堿基(或者氨基酸)的百分比是相同的。這種比對和百分比同源性或者序列同一性可以使用本領域已知的軟件程序來測定,例如ausubel等,eds.(2007)currentprotocolsinmolecularbiology。生物等效多核苷酸是那些具有上述指定的百分比同源性和編碼具有相同或者相似生物活性的多肽。
術語“等效核酸或多核苷酸”是指與核酸或其互補序列的核苷酸序列具有一定程度的同源性或者序列同一性的核苷酸序列的核酸。雙鏈核酸的同源物意在包括與或者與其互補序列具有一定程度同源性的核苷酸序列的核酸。在一個方面,核酸的同源物能夠與核酸或其互補序列雜交。同樣,“等效多肽”是指與參考多肽的氨基酸序列具有一定程度同源性或者序列同一性的多肽。在一些方面,所述序列同一性是至少約70%、75%、80%、85%、90%、95%、98%或99%。在一些方面,所述等效序列保留參考序列的活性(例如表位結合)或者結構(例如鹽橋)。
雜交反應可以在不同“嚴格性”的條件下進行。一般,低嚴格雜交反應在約10×ssc,40℃下或者等效離子強度/溫度的溶液中進行。中嚴格雜交通常在約6×ssc,50℃下進行,以及高嚴格雜交反應一般在約1×ssc,60℃下進行。雜交反應還可以在本領域技術人員熟知的“生理條件”下進行。生理條件的非限制性實例是通常在細胞中發現的溫度、離子強度、ph和mg2+的濃度。
如本文所用,術語“可檢測標記”意指直接或者間接地與待檢測組合物(例如多核苷酸或者蛋白質例如抗體)直接或者間接綴合的可檢測的化合物或者組合物,以產生“標記的”組合物。該術語還包括與多核苷酸綴合的序列,其將在插入序列表達時提供信號,例如綠色熒光蛋白(gfp)等。所述標記可以由自身檢測(例如放射性同位素標記或者熒光標記)或者在酶標記的情況下,可以催化可檢測的底物化合物或者組合物的化學變化。這些標記可以適合于小規模檢測或者更適合于高通量篩選。因此,合適的標記包括但不限于放射性同位素、熒光染料、化學發光化合物、染料和蛋白質,包括酶。所述標記可以簡單地檢測或者可以定量。簡單地檢測的響應一般包括其存在僅被證實的響應,而被量化的響應一般包括具有可量化(例如可報告的數字)值(例如強度、極化和/或其它性質)的響應。在發光或者熒光測定中,可檢測的響應可能由直接使用與實際參與結合的測定組分相關聯的發光體或熒光團,或者間接使用與另一個(例如報道分子或指示劑)組分相關聯的發光體或者熒光團產生。
如本文所用,“抗體”或者“抗原結合多肽”是指特異性識別并結合抗原的多肽或者多肽復合物。抗體可以是一個完整抗體和任何抗原結合片段或者其單鏈。因此,術語“抗體”包括含有分子的任何蛋白質或肽,所述分子包含結合抗原具有生物活性的免疫球蛋白分子的至少一部分。這樣的實例包括但不限于重鏈或輕鏈的互補決定區(cdr)或者其配體結合部分、重鏈或者輕鏈可變區、重鏈或者輕鏈恒定區、框架(fr)區或者其任何部分、或者結合蛋白的至少一部分。
如本文所用,術語“抗體片段”或者“抗原結合片段”是抗體的一部分,例如f(ab')2、f(ab)2、fab'、fab、fv、scfv等。不管結構如何,抗體片段與被完整抗體識別的相同抗原結合。術語“抗體片段”包括適體、鏡像異構體和雙抗體。術語“抗體片段”還包括通過結合特異性抗原形成復合物而起抗體作用的任何合成或者基因工程蛋白。
“單鏈可變片段”或者“scfv”是指免疫球蛋白的重鏈(vh)和輕鏈(vl)可變區的融合蛋白。在一些方面,所述區域與10至約25個氨基酸的短接頭肽連接。所述接頭可富含靈活性的甘氨酸以及溶解性的絲氨酸或蘇氨酸,并且可以將vh的n-末端與vl的c-末端連接,或反之亦然。盡管去除了恒定區并且引入了接頭,該蛋白質還是保留了原始免疫球蛋白的特異性。scfv分子是本領域已知的并且描述于例如美國專利no:5,892,019中。
術語“抗體”包括可以在生物化學上區分的多種類型廣泛的多肽。本領域技術人員知道重鏈分為γ、μ、α、δ或者ε,其中有一些亞類。該鏈的性質將抗體的“類別”分別確定為igg、igm、igaigg或ige。免疫球蛋白亞類(同種型),例如igg1、igg2、igg3、igg4、igg5等,是經過充分表征的并且已知其賦予了功能特異性。根據本公開,這些類別和同種型的抗體中的每個的修飾形式對于技術人員而言都是易于辨別的,因此它們都在本發明的范圍內。所有免疫球蛋白類型清楚地在本公開的范圍內,以下討論總體上針對免疫球蛋白分子的igg類別。關于igg,其是標準免疫球蛋白分子,包含兩條相同的分子量約23,000道爾頓的輕鏈多肽和兩條相同的分子量為53,000-70,000的重鏈多肽。四條鏈通常通過二硫鍵以“y”構型連接,其中輕鏈在"y"的開口處開始括住重鏈并延續至整個可變區。
本公開的抗體、抗原結合多肽、變體或者其衍生物包括但不限于多克隆、單克隆、多特異性、人、人源化、靈長類化或者嵌合抗體;單鏈抗體;表位結合片段,例如fab、fab'和f(ab')2、fd、fvs、單鏈fvs(scfv)、單鏈抗體、二硫鍵連接的fv(sdfv)、包含vl或vh結構域的片段、通過fab表達文庫產生的片段;以及抗獨特型(抗-id)抗體(包括例如本文公開的light抗體的抗-id抗體)。本公開的免疫球蛋白或者抗體分子可以是任何類型(例如igg、ige、igm、igd、iga和igy)、類別(例如igg1、igg2、igg3、igg4、iga1和iga2)或者亞類的免疫球蛋白分子。
輕鏈分為kappa或lambda(κ,λ)。每種重鏈類可與κ或者λ輕鏈結合。一般地,當免疫球蛋白由雜交瘤、b細胞或者遺傳改造的宿主細胞產生時,輕鏈和重鏈彼此共價鍵合,并且兩條重鏈的“尾”部通過共價二硫鍵或者非共價鍵相互結合。在重鏈中,氨基酸序列是由位于y構型的叉狀末端的n末端開始直至位于各條鏈底端的c末端。
輕鏈和重鏈均被分成結構和功能同源性區域。術語“恒定的”和“可變的”作為功能使用。在這方面,應當理解,輕(vl)鏈和重(vh)鏈部分的可變結構域決定抗原識別和特異性。相反,輕鏈(cl)和重鏈(ch1、ch2或ch3)的恒定結構域賦予重要的生物學性質,例如分泌、經胎盤運動性、fc受體結合、補體結合等。按照慣例,隨著恒定區結構域與抗體的抗原結合位點或氨基末端的距離越遠,該結構域的數量增加。n-末端部分是可變區并且在c-末端部分是恒定區,所述ch3和cl結構域實際上分別包含重鏈和輕鏈的羧基末端。
如上所述,可變區允許抗體選擇性地識別并且特異性結合抗原上的表位。換言之,抗體的vl結構域和vh結構域、或者互補決定區(cdr)的亞區相結合,形成了定義為三維抗原結合位點的可變區。這種四元抗體結構在y的各個臂末端處形成了抗原結合位點。更具體地,抗原結合位點是由每個vh和vl鏈的三個cdr來定義的(即cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3)。在一些情況下,例如衍生自駱駝科物種或者基于駱駝科動物免疫球蛋白改造的某些免疫球蛋白分子,完整的免疫球蛋白分子可以僅由重鏈構成而不具有輕鏈。例如參見hamers-casterman等,nature363:446-448(1993)。
在天然抗體中,存在于各個抗原結合結構域中的6個“互補決定區”或者“cdr”是短的、非連續的氨基酸序列,當所述的抗體在水性環境中呈現其三維構型時,所述的氨基酸序列特異性地定位,從而形成抗原結合結構域。抗原結合結構域中的其余氨基酸稱為“框架”區,其顯示低的分子內可變性。框架區主要采用β-片構型而cdrs形成連接β-片結構的環,并且在某些情況下所述的環形成了β-片結構的一部分。因此,框架區起到了形成支架的作用,其中所述的支架使得cdr通過鏈內非共價作用以正確的方向定位。由定位的cdr形成的抗原結合位點定義了與位于免疫反應性抗原上的表位互補的表面。這種互補的表面促進了抗體與其同源的表位的非共價結合。對于任何給定的重鏈可變區和輕鏈可變區,本領域的任何普通技術人員都可以容易地分別鑒定含cdr區域和框架區的氨基酸,這是因為這些氨基酸已經被精確地定義(參見“sequencesofproteinsofimmunologicalinterest,”kabat,e.等,u.s.departmentofhealthandhumanservices,(1983);以及chothiaandlesk,j.mol.biol.,196:901-917(1987),其整體通過引用并入本文)。
在本領域中使用和/或接受的術語具有兩個或者多個定義的情況下,本文所使用的術語的定義意在包括所有這樣的含義,除非明確地做出了相反的說明。具體實例為術語“互補決定區”(“cdr”)的使用,該術語描述的是在重鏈和輕鏈多肽的可變區內發現的非連續的抗原結合位點。該特定區域已由kabat等,u.s.dept.ofhealthandhumanservices,“sequencesofproteinsofimmunologicalinterest”(1983)和由chothia等,j.mol.biol.196:901-917(1987)描述,其整體通過引用并入本文。根據kabat和chothia,在將該cdr彼此對比時,其定義包括氨基酸殘基的重疊或亞區。然而,關于抗體或其變體的cdr的定義應用均在本文所定義和使用的術語的范圍內。包含了特定cdr的確切殘基數將隨著cdr的序列和大小的變化而變化。根據抗體的可變區的氨基酸序列,本領域的技術人員可以通過常規方式確定哪些殘基包含特定的cdr。
本文公開的抗體可來自任何動物來源,包括鳥類和哺乳動物。優選地,所述抗體是人、鼠、驢、兔、山羊、豚鼠、駱駝、美洲駝、馬或者雞抗體。在另一個實施方案中,所述變區在來源中可以是condricthoid(例如來自鯊魚)。
如本文所用,術語“重鏈恒定區”包括衍生自免疫球蛋白重鏈的氨基酸序列。包含重鏈恒定區多肽包含以下中的至少一種ch1結構域、鉸鏈(例如上游鉸鏈區,中游鉸鏈區和/或下游鉸鏈區)結構域、ch2結構域、ch3結構域或者其變體或片段。例如,用于本公開的結合多肽可以包括:包含ch1結構域的多肽鏈;包含ch1結構域,鉸鏈結構域的至少一部分和ch2結構域的多肽鏈;包含ch1結構域和ch3結構域的多肽鏈;包含ch1結構域、鉸鏈結構域的至少一部分和ch3結構域的多肽鏈,或者包含ch1結構域、鉸鏈結構域、ch2結構域和ch3結構域的至少一部分的多肽鏈。在另一個實施方案中,本公開的多肽包括包含ch3結構域的多肽鏈。此外,用于本公開的結合多肽可以缺乏ch2結構域的至少一部分(例如ch2結構域的全部或部分)。如上所述,本領域普通技術人員應當理解所述重鏈恒定區可以被修飾,使得它們在氨基酸序列上與天然存在的免疫球蛋白分子不同。
本文公開的抗體的重鏈恒定區可以衍生自不同的免疫球蛋白分子。例如多肽的重鏈恒定區可以包含衍生自igg1分子的ch1結構域和衍生自igg3分子的鉸鏈區。在另一個實例中,重鏈恒定區可以包含部分衍生自igg1分子和部分衍生自igg3分子的鉸鏈區。在另一個實例中,重鏈部分可以包含部分地衍生自igg1分子和部分衍生自igg4分子的嵌合鉸鏈。
如本文所用,術語“輕鏈恒定區”包括衍生自抗體輕鏈的氨基酸序列。優選地,輕鏈恒定區包含恒定kappa(κ)結構域或者恒定lambda(λ)結構域中的至少一個。
“輕鏈-重鏈對”是指可以通過輕鏈的cl結構域和重鏈的ch1結構域之間的二硫鍵形成二聚體的輕鏈和重鏈的集合。
如前所述,多種免疫球蛋白類別的恒定區的亞基結構和三維構型是熟知的。如本文所用,術語“vh結構域”包括免疫球蛋白重鏈的氨基末端可變結構域并且術語“ch1結構域”包括免疫球蛋白重鏈的第一(氨基最末端)恒定區結構域。ch1結構域與vh結構域相鄰并且是免疫球蛋白重鏈分子的鉸鏈區的氨基末端。
如本文所用,術語“ch2結構域”包括例如采用常規的編號方案由抗體的約第244個殘基延伸至第360個殘基(第244個殘基至第360個殘基,kabat編號系統;第231-340個殘基,eu編號系統;參見kabat等,u.s.dept.ofhealthandhumanservices,“sequencesofproteinsofimmunologicalinterest”(1983))。ch2結構域是獨特的,因為其不與另一個結構域緊密配對。而是,兩條n連接的支鏈糖鏈插入在完整的天然igg分子的兩個ch2結構域之間。此外,已經充分證明了所述ch3結構域從ch2結構域延伸至igg分子的c末端,并且包含約108個殘基。
如本文所用,術語“鉸鏈區”包括將ch1結構域與ch2結構域連接的重鏈分子的部分。該鉸鏈區包含大約25個殘基,并且是柔性的,因此使得兩個n末端抗原結合區可以獨立地移動。鉸鏈區可以細分為三個不同的結構域:上游,中部和下游鉸鏈結構域(roux等,j.immunol161:4083(1998))。
如本文所用,術語“二硫鍵”包括在兩個硫原子之間形成的共價鍵。氨基酸半胱氨酸包含可以與第二個巰基形成二硫鍵或橋的巰基。在大部分天然存在的igg分子中,ch1和cl區通過二硫鍵連接,并且兩個重鏈在對應于采用kabat標號系統的239和242的位置(采用eu編號系統的226或229的位置)處通過二硫鍵連接。
如本文所用,術語“嵌合抗體”被用于指其中免疫反應性區域或位點得自或衍生自第一種物種,而恒定區(根據本公開可以是完整的、部分的或者修飾的)得自第二種物種的任何抗體。在某些實施方案中,靶結合區或者位點來自非人來源(例如小鼠或靈長類動物)而恒定區是人的。
通過“特異性結合”或“對其具有特異性”,一般是指抗體通過其抗原結合結構域與表位結合,并且這種結合需要抗原結合結構域與所述表位之間一定的互補性。根據該定義,當抗體通過其抗原結合結構域比該抗體與隨意的、無關的表位結合得更容易與表位結合時,稱其與表位“特異性結合”。如本文所用,術語“特異性”用于對某種抗體與某種表位結合的相對親和力進行定性。例如,對于給定表位,可認為抗體“a”比抗體“b”具有更高的特異性,或者與相關的表位“d”相比,可以認為抗體“a”與表位“c”的結合具有更高的特異性。
如本文所用,術語“融合的”,“連接的”和“綴合的”是指雙特異性抗體中第一抗原結合部分和第二抗原結合部分之間的連接。這種連接可以通過重組(例如重組融合蛋白)或者化學方法引入。合適的化學手段的非限制性示例包括共價鍵、二硫鍵、氫鍵、靜電鍵合和構象鍵,并且可涉及同型雙功能或者異型雙功能交聯劑的使用。合適的交聯和綴合方法公開于sen等,j.hemato.stemcellres.2001,10:247-260;美國專利no:us6,642,363和美國申請no:20060002852。
術語“同種異體”是指衍生自或者源于不同個體的樣品。同種異體樣品可以來自遺傳不同、遺傳相似(例如同胞)的不同個體。關于細胞、血漿或血清,該術語表示獲得組合物的個體與將施用組合物的個體不同。同種異體還可以指從多于一個非同一個體(供體)產生的樣品。
如本文所用,術語“治療”(“treat”或“treatment”)是指治療性治療和預防性或防護性措施,其中目的在于預防或減慢(減輕)不需要的生理變化或紊亂,例如癌癥的進展。有益的或者所需要的臨床結果包括但不限于減輕癥狀、減輕疾病程度、穩定(即,不惡化)疾病狀態、延遲或者減緩疾病進展、改善或者減輕疾病狀態,以及緩解(部分或者全部),無論是可檢測的或者不可檢測的。與在未接受治療下所期望的存活相比,“治療”還可以指延長的存活。需要治療的對象包括已經患有癥狀或紊亂的那些、以及傾向于具有癥狀或紊亂的那些或者其中癥狀或紊亂有待預防的那些。
“受試者”或者“個體”或者“動物”或者“患者”或者“哺乳動物”是指需要診斷,預后或者治療的任何受試者,尤其是哺乳動物受試者。哺乳動物受試者包括人,家養動物,農場動物,和動物園、競技或者寵物動物例如狗、貓、豚鼠、兔、大鼠、小鼠、馬、牛、奶牛等。
如本文所用,短語諸如“對需要治療的患者”或者短語“需要治療的受試者”包括如下受試者,例如哺乳動物受試者,該受試者受益于本發明所使用的抗體或者組合物的施用,例如用于檢測、用于診斷程序和/或用于治療。
雙特異性抗體介導的基于細胞的免疫治療
本公開提供了用于改善治療功效并且減少基于細胞的免疫治療的不良作用的組合物和方法。通過將對腫瘤細胞具有特異性的抗體附著到免疫細胞(例如細胞毒性免疫細胞),該抗體可以有效地將免疫細胞靶向腫瘤(圖1)。出乎意料地,這種靶向導致腫瘤殺傷的增強,表明靶向和細胞毒性之間的協同作用。
存在多種將抗體附著到細胞的方法。在一個方面,抗體還對免疫細胞具有特異性;因此這樣的抗體是具有雙重結合特異性的雙特異性抗體。通過將這樣的抗體與免疫細胞孵育,抗體將與免疫細胞結合。然后可以將抗體結合的免疫細胞施用于癌癥患者,其中該抗體識別腫瘤細胞并因此使免疫細胞接近腫瘤細胞。
在一些方面,所述免疫細胞是細胞毒性免疫細胞。示例性細胞毒性免疫細胞包括但不限于cik細胞、t細胞、cd8+t細胞、活化的t細胞、單核細胞、自然殺傷(nk)細胞、nkt細胞、淋巴因子激活的殺傷(lak)細胞、巨噬細胞和樹突細胞。
在一些實施方案中,所述細胞毒性免疫細胞是cik細胞。在一些實施方案中,雙特異性抗體與cik細胞和腫瘤細胞的結合提高了cik介導的針對腫瘤細胞的細胞毒性。在一些實施方案中,這樣的結合誘導cik細胞的活化以及cik細胞針對腫瘤細胞或者細胞系的細胞毒性。在一些實施方案中,所述結合誘導cik細胞的活化,其可以導致cik細胞的脫粒。
在一些實施方案中,所述雙特異性抗體包含對腫瘤抗原具有特異性的第一抗原結合部分。腫瘤抗原的非限制性示例包括egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72、cix、psma、葉酸結合蛋白、gd2、gd3、gm2、vegf、vegfr、整聯蛋白αvβ3、整聯蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白。在一些實施方案中,所述第一抗原結合部分對與相應的非腫瘤細胞相比在腫瘤細胞中過表達蛋白質或者肽具有特異性。
在一些實施方案中,所述雙特異性抗體包含結合細胞毒性免疫細胞的第二抗原結合部分。所述第二抗原結合部分是特異性結合在細胞毒性免疫細胞(例如cik細胞)表面上表達的抗原或者蛋白質或者多肽的任何分子。適用于本公開的細胞毒性免疫細胞表面上表達的示例性非限制性抗原可包括cd2、cd3、cd4、cd5、cd8、cd11a、cd11b、cd14、cd16a、cd27、cd28、cd45、cd45ra、cd56、cd62l、fc受體、lfa、lfa-1、tcrαβ、ccr7、巨噬細胞炎癥蛋白1a、穿孔素和fas配體。在一些實施方案中,所述第二抗原結合部分結合細胞毒性免疫細胞(例如cik細胞)的cd3。在一些實施方案中,所述第二抗原結合部分結合細胞毒性免疫細胞的cd56。在一些實施方案中,所述第二抗原結合部分結合細胞毒性免疫細胞的fc受體。在一些實施方案中,所述雙特異性抗體的fc區結合細胞毒性免疫細胞的fc受體。
在一些實施方案中,所述雙特異性抗體對腫瘤抗原和cik細胞具有特異性,其使表達腫瘤抗原的腫瘤細胞接近cik細胞,導致通過cik細胞的抗腫瘤細胞毒性消除腫瘤細胞。在一些實施方案中,所述雙特異性抗體對腫瘤抗原具有特異性,但對cik細胞不具有特異性,然而,所述雙特異性抗體的fc區可以結合cik細胞的fc受體,其進而使腫瘤細胞緊密接近cik細胞,導致通過cik細胞的抗腫瘤細胞毒性消除腫瘤細胞。在一些實施方案中,所述雙特異性抗體對cik細胞具有特異性,但對腫瘤細胞不具有特異性,然而,所述雙特異性抗體的fc區可以結合腫瘤細胞的fc受體,其進而使所述腫瘤細胞緊密接近cik細胞,導致通過cik細胞的抗腫瘤細胞毒性消除腫瘤細胞。
在一些實施方案中,不對稱雙特異性抗體的單價單元對腫瘤抗原具有特異性,并且所述雙特異性抗體的單鏈單元對cik細胞具有特異性。在一些實施方案中,不對稱雙特異性抗體的單價單元對cik細胞具有特異性,并且所述雙特異性抗體的單鏈單元對腫瘤抗原具有特異性。另一種雙特異性抗體具有兩個單鏈單元,其中一個對腫瘤抗原具有特異性并且另一個對cik細胞具有特異性。這些雙特異性抗體可以使細胞毒性免疫細胞(例如cik細胞)接近腫瘤細胞,導致通過細胞毒性免疫細胞的抗腫瘤細胞毒性消除腫瘤細胞。
在一些實施方案中,本公開提供了通過從患者獲得pbl或者pbmc樣品來治療患者(包括癌癥患者)的方法;用抗cd3抗體,ifn-γ和il-2孵育所述pbl或者pbmc以獲得cik細胞;用雙特異性抗體武裝所述cik細胞,其中每個雙特異性抗體包含對腫瘤抗原具有抗原結合特異性的第一抗原結合部分,和與所述cik細胞結合的第二抗原結合部分,并且施用所述具有結合的雙特異性抗體武裝的cik細胞到有需要的患者。本公開的抗原結合多肽、變體或者衍生物可用于與癌癥或者傳染病相關的某些治療和診斷方法。當施用于患者時,所述雙特異性抗體武裝的細胞毒性免疫細胞將靶向和消除病原體感染的腫瘤細胞或者細胞。
本文公開的所述組合物和方法為腫瘤或者癌癥或者感染病原體的患者提供了意想不到的和令人驚訝的有效治療,因為武裝所述細胞毒性免疫細胞以實現理想的治療效果所需的雙特異性抗體的濃度低。本公開的雙特異性抗體能夠使所述細胞毒性免疫細胞接近腫瘤細胞或感染的細胞以使所述細胞毒性免疫細胞裂解它們。
在一些實施方案中,為了實現相同的期望效果,武裝所述細胞毒性免疫細胞所需的所述雙特異性抗體的濃度比本領域中其他組合物至少低一個數量級。在一些實施方案中,用每106個細胞毒性免疫細胞0.001ng至50ng的所述雙特異性抗體的量武裝所述細胞。在一些實施方案中,用每106個細胞0.01ng至5ng的所述雙特異性抗體的量武裝所述細胞。在一些實施方案中,用每106個細胞0.1至1ng的所述雙特異性抗體的量武裝所述細胞。在一些實施方案中,用每106個細胞1ng的所述雙特異性抗體的量武裝所述細胞。在一些實施方案中,用于武裝所述細胞毒性免疫細胞的所述雙特異性抗體的濃度為100ng、50ng、40ng、30ng、20ng、15ng、10ng、5ng、4ng、3ng、2ng、1ng、0.5ng、0.1ng、0.05ng、0.01ng、0.005ng和0.001ng每106個細胞毒性免疫細胞。
細胞因子誘導的殺傷(cik)細胞
本公開的所述組合物包含雙特異性抗體和細胞毒性免疫細胞,其中所述雙特異性抗體包含對腫瘤抗原具有特異性的第一抗原結合部分,和與所述細胞結合的第二抗原結合部分。在一些實施方案中,所述細胞毒性免疫細胞是細胞因子誘導的殺傷(cik)細胞、t細胞、自然殺傷(nk)細胞、自然殺傷t細胞或者淋巴因子激活的殺傷(lak)細胞。
cik細胞是來自初始體細胞,例如t細胞或者外周血淋巴細胞(pbl)的離體或者體外擴增細胞的異質群體。cik具有混合的t和nk細胞表型,并且能夠同時表達t細胞標記物cd3和nk細胞標記物cd56。在一些實施方案中,cik細胞的異質群體包含至少兩個細胞。在一些實施方案中,所述cik細胞是cd3+cd56+細胞。在一些實施方案中,所述cik細胞是cd3+cd56-細胞。在一些實施方案中,所述cik細胞是cd3-cd56+細胞。在一些實施方案中,所述cik細胞針對腫瘤細胞或者細胞系具有非mhc限制性細胞溶解活性。在一些實施方案中,所述cik細胞具有抗腫瘤活性而不受tcr和mhc相互作用的限制。在一些實施方案中,所述cik細胞是具有不同tcr特異性的效應cd8t細胞,并且可以以非mhc限制性方式溶解腫瘤細胞。在一些實施方案中,cik細胞的mhc非限制性腫瘤殺傷主要基于存在于cik細胞和腫瘤細胞或者細胞系上的各種分子之間的相互作用。
cik細胞可以從具有初始cd4-cd8-表型的cd3+t淋巴細胞產生。cik細胞還可以由外周血單核細胞(即,pbmc)、外周血淋巴細胞(即,pbl)、以及骨髓細胞、臍帶血細胞或者能夠產生cik細胞的任何細胞類型產生。
用于擴增cik細胞的標準培養條件是本領域普通技術人員容易理解的,例如如lu等所述(anovelpopulationofexpandedhumancd3+cd56+cellsderivedfromtcellswithpotentinvivoantitumoractivityinmicewithseverecombinedimmunodeficiency,j.immunol.,1994,153(4):1687-1696),其需要添加可溶性因子,例如ifn-γ、il-2和抗cd3抗體幾天至數周。不受理論的約束,加入ifn-γ以激活單核細胞并提供引起cik細胞的細胞毒性發展的信號。抗cd3抗體用于激活t細胞并提供促有絲分裂信號以誘導t細胞增殖,而il-2的添加隨后維持所述t細胞增殖。il-1、il-7和胸腺球蛋白的添加也已顯示有利于增加cik細胞的細胞毒性潛力(jiangj等,cytokine-inducedkillercellspromotingantitumorimmunity,j.translationalmed,2013,11:83;zollb等,generationofcytokine-inducedkillercellsusingexogenousinterleukin-2,-7or-12,cancerimmunolimmunother,1998,47(4):221-6)。
在一些實施方案中,同時表達t細胞標志物cd3和自然殺傷(即,nk)細胞標志物cd56(即,cd3+cd56+細胞)的擴增的cik細胞,具有針對腫瘤細胞或細胞系的細胞毒性,也具有初始靜息和記憶t細胞的表型。在一些實施方案中,當在用于擴增cik細胞的標準培養條件下培養約21天時,超過90%的擴增細胞為cd3+細胞。在一些實施方案中,cd3+cd56+細胞的百分比在培養幾天至數周后還增加。在一些實施方案中,cd3+cd56+cik細胞還共表達cd2、tcrαβ和cd8。在一些實施方案中,cd3+cd56+cik細胞不表達nk細胞的標志物cd16。
在一些實施方案中,cd3+cd56+細胞針對腫瘤細胞和細胞系介導的細胞毒作用不依賴于mhc。在一些實施方案中,cik不介導抗體依賴細胞介導的細胞毒作用(adcc)。在一些實施方案中,在所述培養條件下擴增的cik來源于t細胞而不來自nk細胞。在一些實施方案中,表達cd8t細胞標志物的cik比表達cd4t細胞標志物的cik具有更高的cd56表達水平。在一些實施方案中,cik細胞表達cd45ra、ccr7、cd62l、cd11a、cd27、cd28、巨噬細胞炎性蛋白1a、穿孔素和fas配體。在一些實施方案中,用于cik細胞的標準培養條件產生的cik細胞的異質群體包含具有不同tcr特異性但針對腫瘤細胞或細胞系的非mhc限制性細胞溶解活性的效應cd8t細胞。
在培養擴增后,cik細胞的產生和擴增速率可以從初始批細胞的幾倍到幾千倍變化。在擴增培養期間添加瞬時的同種異體刺激或者t調節細胞的消耗也可用于產生和擴增cik細胞。在培養擴增結束時,cik細胞通常包含分別具有cd3+cd56+和cd3+cd56-細胞兩個主要亞型的cd3+t淋巴細胞的異質群體,。在一些實施方案中,所述cd3+cd56+片段認為是主要負責cik細胞的非mhc限制性抗腫瘤活性。在其他實施方案中,所述cd3+cd56-片段也可以具有非mhc限制性抗腫瘤活性。
在一些實施方案中,cik細胞表達cd8+或者cd4、或兩者或非兩者。在一些實施方案中,cik細胞主要是cd4-cd8+細胞。在其他實施方案中,cd4+cd8-cik細胞還可以存在于大量培養物中,而cd4+cd8+或者cd4-cd8-cik細胞較不頻繁。在一些實施方案中,在cd3+cd56+cik細胞中更多的表現出終末分化的晚期效應物表型(cd45ro+;cd27低;cd28低;cd62l-;ccr7-),而cd3+cd56-的對應物表現出更早的記憶特征。
在一些實施方案中,cik細胞對來自樣品的腫瘤細胞系或者新鮮分離的腫瘤細胞具有強效的細胞毒活性,所述樣品包括急性髓性白血病、慢性髓性白血病、淋巴瘤、造血癌、肝癌、胃癌、肺癌、神經膠質瘤、結腸直腸癌和腎癌、非小細胞肺癌、肝細胞癌、復發性血液惡性腫瘤、非霍奇金淋巴瘤等。盡管cik細胞對腫瘤細胞或者細胞系顯示出顯著的特異性,但它們對正常組織或者細胞幾乎沒有或者沒有細胞溶解活性。在一些實施方案中,cik細胞可以用作癌癥患者的過繼性細胞免疫治療。
在一些實施方案中,cik細胞的細胞溶解活性不涉及mhc和t細胞受體(即,tcr)間相互作用,因為cik細胞的腫瘤細胞觸發的細胞溶解活性不能通過中和mhc和tcr相互作用而阻斷,例如抗cd3和抗hla-i類抗體。
在一些實施方案中,雙特異性抗體與cik細胞和腫瘤細胞的結合是cik介導的針對腫瘤細胞或者細胞系的細胞毒性所需的。在一些實施方案中,cik細胞表達白細胞功能相關的抗原-1(lfa-1),其可以與由腫瘤細胞或者細胞系表達的配體icam-1、-2和-3結合。cik細胞的lfa-1與icam在腫瘤細胞上的結合可以參與效應物/靶向識別物以及穩定綴合物的形成。在一些實施方案中,抗lfa-1抗體可以抑制cik雙特異性抗體腫瘤細胞綴合物的形成以及針對腫瘤細胞的cik細胞的細胞毒性。
在一些實施方案中,cik細胞表達活化nk受體,包括但不限于nkg2d、dnax輔助分子-1(dnam-1)和nkp30。nk受體(例如nkg2d)的配體,例如mica/b和ulbps,通常在腫瘤細胞或者細胞系上表達。在一些實施方案中,nk受體與其配體的連接可以誘導cik細胞的活化,其可以引起針對腫瘤細胞或者細胞系的脫粒和細胞毒作用。在一些實施方案中,通過抗體中和nk受體可以阻斷針對腫瘤細胞或細胞系的cik細胞毒性。在一些實施方案中,在cik細胞上表達的nk受體參與cik細胞的tcr非依賴性腫瘤細胞識別和腫瘤細胞的非mhc限制性殺傷。
雙特異性抗體結合
在一些實施方案中,所述雙特異性抗體包含對腫瘤抗原具有特異性的第一抗原結合部分。在一些實施方案中,腫瘤抗原選自所述組,該組由egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72、cix、psma、結合蛋白、gd2、gd3、gm2、vegf、vegfr、整聯蛋白αvβ3、整聯蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白組成。
第一抗原結合部分
在一些實施方案中,本公開的雙特異性抗體的第一抗原結合部分是任何分子并且對在腫瘤細胞的細胞表面上表達的腫瘤抗原具有特異性。
豐富的腫瘤抗原是本領域已知的并且通過篩選可以容易地鑒定新的腫瘤抗原。腫瘤抗原的非限制性實例包括egfr、her2、ep-cam、cd20、cd30、cd33、cd47、cd52、cd133、cea、gpa33、粘蛋白、tag-72、cix、psma、葉酸結合蛋白、gd2、gd3、gm2、vegf、vegfr、整聯蛋白αvβ3、整聯蛋白α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和生腱蛋白。
在一些實施方案中,與相應的非腫瘤細胞相比,所述第一抗原結合部分對腫瘤細胞上過表達的蛋白質具有特異性。如本文所用,“相應的非腫瘤細胞”是指與腫瘤細胞的起源具有相同細胞類型的非腫瘤細胞。注意,這樣的蛋白質不必與腫瘤抗原不同。非限制性實例包括在大多數結腸、直腸、乳腺、肺、胰腺和胃腸道癌中過表達的癌胚抗原(cea);在乳腺、卵巢、結腸、肺、前列腺和子宮頸癌中頻繁過表達的調蛋白受體(her-2,neu或c-erbb-2);在包括乳腺、頭和頸、非小細胞肺和前列腺的實體瘤的范圍內高度表達的表皮生長因子受體(egfr);去唾液酸糖蛋白受體;轉鐵蛋白受體;在肝細胞上表達的絲氨酸蛋白酶復合物受體;在胰腺導管腺癌細胞上過表達的成纖維細胞生長因子受體(fgfr);用于抗血管生成基因治療的血管內皮生長因子受體(vegfr);在90%的非粘液性卵巢癌中選擇性地過表達的葉酸受體;細胞表面糖萼;碳水化合物受體和聚合免疫球蛋白受體,其可用于向呼吸道上皮細胞的基因遞送并且對治療肺病如囊性纖維化有吸引力。
在一些實施方案中,所述第一抗原結合部分是針對病原體結合部分的多克隆群體的成員。本公開的組合物可以靶向的示例性非限制性病原體可以包括寄生蟲、細菌、真菌和病毒病原體。
在一些實施方案中,所述第一抗原結合部分對微生物具有特異性。微生物的非限制性實例包括微生物表面受體和內毒素。內毒素的實例包括但不限于脂多糖(lps)和脂寡糖(los)。
第二抗原結合部分
在一些實施方案中,所述雙特異性抗體包含與細胞毒性免疫細胞結合的第二抗原結合部分。在一些實施方案中,所述細胞是細胞因子誘導的殺傷(cik)細胞、t細胞、自然殺傷(nk)細胞、自然殺傷t細胞或者淋巴因子激活的殺傷(lak)細胞。在一些實施方案中,所述第二抗原結合部分與所述細胞因子誘導的殺傷(cik)細胞的細胞表面或者膜蛋白結合。在一些方面,所述蛋白質是cd3或者fc受體。在一些實施方案中,所述第二抗原結合部分與所述細胞的cd3結合。在一些實施方案中,所述第二抗原結合部分與所述細胞的cd56結合。在一些實施方案中,所述雙特異性抗體的fc部分與所述細胞的fc受體結合。
在一些實施方案中,第二抗原結合部分是與細胞毒性免疫細胞(例如cik細胞)表面上表達的抗原特異性結合的任何分子。所述第二抗原結合部分對細胞毒性免疫細胞上的抗原是特異性的。示例性細胞毒性免疫細胞包括但不限于cik細胞、t細胞、cd8+t細胞、活化的t細胞、單核細胞、自然殺傷(nk)細胞、nkt細胞、淋巴因子激活的殺傷(lak)細胞、巨噬細胞和樹突細胞。所述第二抗原結合部分與細胞毒性免疫細胞表面上表達的抗原特異性結合。適用于本公開的細胞毒性免疫細胞表面表達的示例性非限制性抗原可包括cd2、cd3、cd4、cd5、cd8、cd11a、cd11b、cd14、cd16a、cd27、cd28、cd45、cd45ra、cd56、cd62l、fc受體、lfa、lfa-1、tcrαβ,ccr7、巨噬細胞炎癥蛋白1a、穿孔素和fas配體。在一些實施方案中,所述第二抗原結合部分與所述細胞毒性免疫細胞,例如cik細胞結合。在一些實施方案中,所述第二抗原結合部分與cd56結合。在一些實施方案中,所述第二抗原結合部分與lfa-1結合。在一些實施方案中,所述第二抗原結合部分與fc受體結合。在一些實施方案中,所述msbody的fc區與所述細胞毒性免疫細胞,例如cik細胞上的fc受體結合。
一旦鑒定了所述細胞毒性免疫細胞和所述特異性抗原,可以選擇特異性msbody用作所述第二抗原結合部分。適合用作第二抗原結合部分的示例性非限制性分子是本領域熟知的,并且可包括抗體、抗體片段、單鏈可變片段(scfv)和抗體模擬物。適用于本公開的這些抗原結合組分可以使用本領域熟知的方法產生或者購自商業供應商(例如,rdidivisionoffitzgeraldindustriesintl(actonmass.,usa)和ebioscience,(sandiego,calif.usa)、santacruzbiotechnology(santacruz,calif.usa)和abcamintl(cambridge,mass.usa))。在一些實施方案中,例如,所述抗體的修飾過的,以產生抗體片段(例如fab、f(ab')2、scfv)。在一些實施方案中,所述結合部分是非抗體分子,例如抗體模擬物。適用于本公開的非限制性示例性抗體模擬物可包括:anticalins、具有纖連蛋白iii型結構域的多肽、avimers、adnectin以及具有兩個或者多個結合結構域的非糖基化單鏈多肽。
雙特異性抗體
本公開的多核苷酸可以在相同的多核苷酸分子上或者在單獨的多核苷酸分子上編碼抗原結合多肽、變體或其衍生物的整個重鏈和輕鏈可變區。另外,本公開的多核苷酸可以在相同的多核苷酸分子上或者在單獨的多核苷酸分子上編碼抗原結合多肽、變體或其衍生物的重鏈和輕鏈可變區的部分。
本公開的一個實施方案提供了包含兩個不同的抗原結合多肽單元的異二聚體抗體。在一些實施方案中,所述異源二聚體與其相應的同源二聚體在大小上不同,并且所述大小差異可以用于促進異源和同源二聚體的分離。
在一些實施方案中,所述兩個抗原結合多肽單元之一包含輕鏈-重鏈對,如野生型抗體。貫穿本公開,該單元還稱為“單價單元”。在一些方面,另一個抗原結合多肽單元包含單鏈可變片段(scfv)。這樣的scfv可以與抗體的恒定片段(fc)融合。貫穿本公開,該融合肽還稱為“單鏈單元”。
本公開證明這樣的不對稱抗體是穩定的并且保持高的抗原結合率。這是出人意料的,因為已經證明即使在生理條件下單鏈抗體的同源二聚體也是不穩定的。例如ahma等,“scfvantibody:principlesandclinicalapplication”,clinicalanddevelopmentalimmunology,2012:980250(2012),證明基于scfv的igg樣抗體是不穩定的并且需要進一步工程化以減少聚集并提高穩定性。
此外,由于不對稱性,異源二聚體與包含任一個所述抗原結合多肽單元的同源二聚體具有不同的分子量。基于所述異源二聚體和同源二聚體之間的分子量差異,可以容易地從所述同源二聚體中分離出所需的異源二聚體。
容易地從同源二聚體中分離異源二聚體的能力對于制備雙特異性抗體是特別有利的,其中所述兩個抗原結合多肽中的任一個對不同的表位具有特異性。這是因為兩種類型的同源二聚體(即包含單價單元的同源二聚體或者包含單鏈單元的同源二聚體)都不具有由所述異源二聚體提供的所需的雙特異性。
在一個實施方案中,這種雙特異性抗體對腫瘤抗原具有特異性并對cik細胞具有特異性,其使表達腫瘤抗原的腫瘤細胞接近cik細胞,導致通過cik細胞的抗腫瘤細胞毒性消除腫瘤細胞。在另一個實施方案中,這樣的雙特異性抗體僅對腫瘤抗原具有特異性而對cik細胞不具有特異性,然而,所述雙特異性抗體的fc區可以與所述cik細胞的fc受體結合,其進而使表達腫瘤抗原的腫瘤細胞接近所述cik細胞,導致通過cik細胞的抗腫瘤細胞毒性消除腫瘤細胞。
在一些實施方案中,所述單價單元對腫瘤抗原具有特異性,并且所述單鏈單元對cik細胞具有特異性。具有這種排列特異性的不對稱雙特異性抗體還稱為“單價單鏈雙特異性抗體”或者“msbody”。相反,其中所述單價單元對cik細胞具有特異性并且所述單鏈單元對腫瘤抗原具有特異性的不對稱雙特異性抗體稱為“smbody”。另一種雙特異性抗體具有兩個單鏈單元,其中一個對腫瘤抗原具有特異性并且另一個對cik細胞具有特異性,稱為“ssbody”。
因此,在一個實施方案中,提供了一種抗體,其包含:(a)對腫瘤抗原具有特異性的輕鏈-重鏈對和(b)包含單鏈可變片段(scfv)和包含ch2結構域和ch3結構域的fc片段的融合肽,其中所述融合肽對cik細胞具有特異性。
上述任何抗體或者多肽可以進一步包括另外的多肽,例如指導編碼多肽分泌的信號肽、如本文所述的抗體恒定區或者如本文所述的其他異源多肽。
本領域普通技術人員還將理解,本文公開的抗體可以是修飾的,使得它們在氨基酸序列上不同于衍生自天然存在的結合多肽。例如,衍生自指定蛋白的多肽或者氨基酸序列可以是相似的,例如與起始序列具有一定百分比同一性,如其可以是與起始序列60%、70%、75%、80%、85%、90%、95%、98%或者99%的同一性。
此外,可進行導致在“非必需”氨基酸區域保守取代或者改變的核苷酸或者氨基酸取代、缺失或者插入。例如,除了一個或多個個別氨基酸取代、插入或者缺失,例如一個、兩個、三個、四個、五個、六個、七個、八個、九個、十個、十五個、二十個或更多個個別氨基酸取代、插入或者缺失,衍生自指定蛋白的多肽或氨基酸序列可以與起始序列相同。在某些實施方案中,衍生自指定蛋白的多肽或者氨基酸序列相對于起始序列具有1至5個、1至10個、1至15個或者1至20個單個氨基酸取代、插入或者缺失。
在某些實施方案中,抗原結合多肽包含氨基酸序列或者一個或多個通常與抗體不相關的部分。示例性修飾在下面更詳細地描述。例如,本公開的單鏈fv抗體片段可以包含柔性接頭序列,或者可以被修飾以添加功能部分(例如peg、藥物、毒素或者標記)。
本公開的抗體、變體或者其衍生物包括修飾的衍生物,即通過將任何類型的分子共價連接至所述抗體,這樣的共價連接不阻止所述抗體與所述表位結合。所述抗體可以是修飾的,例如但不限制性方式:如通過糖基化、乙酰化、聚乙二醇化、磷酸化、磷酸化、酰胺化、通過已知的保護/封閉基團的衍生化、蛋白水解切割、與細胞配體或者其它蛋白質的連接等。通過已知技術可以進行任何多種化學修飾,包括但不限于特異性化學切割、乙酰化、甲酰化、衣霉素的代謝合成等。另外,所述抗體可以含有一個或者多個非經典氨基酸。
在其他實施方案中,本公開的抗原結合多肽可以包含保守氨基酸取代。“保守氨基酸取代”是一種具有相似側鏈的氨基酸殘基取代所述氨基酸殘基的取代。本領域已經定義具有相似側鏈的氨基酸殘基家族包括堿性側鏈(例如賴氨酸、精氨酸、組氨酸)、酸性側鏈(例如天冬氨酸、谷氨酸)、不帶電的極性側鏈(例如甘氨酸、天冬酰胺、谷氨酰胺、絲氨酸、蘇氨酸、酪氨酸、半胱氨酸)、非極性側鏈(例如丙氨酸、纈氨酸、亮氨酸、異亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支鏈側鏈(例如蘇氨酸、纈氨酸、異亮氨酸)和芳族側鏈(例如酪氨酸、苯丙氨酸、色氨酸、組氨酸)。因此,免疫球蛋白多肽中的非必需氨基酸殘基優選地被來自相同側鏈家族的另一個氨基酸殘基替換。在另一個實施方案中,氨基酸鏈可以用側鏈家族成員中次序和/或組成不同但結構相似的鏈替換。
在一些實施方案中,所述抗體可以與治療劑、前藥、肽、蛋白質、酶、病毒、脂質、生物反應修飾劑、藥物試劑或peg綴合。
所述抗體可以與治療劑綴合或者融合,該治療劑可以包括可檢測標記(例如放射性標記)、免疫調節劑、激素、酶、寡核苷酸、光活性治療劑或者診斷劑、可以是藥物或者毒素的細胞毒性劑、超聲增強劑,非放射性標記,其組合以及本領域已知的其他此類試劑。
所述抗體可以通過與化學發光化合物偶聯進行可檢測標記。然后通過檢測化學反應過程中出現的發光的存在來確定化學發光標記的抗原結合多肽的存在。特別有用的化學發光標記化合物的實例是魯米諾、異魯米諾、芳族吖啶酯、咪唑、吖啶鎓鹽和草酸酯。
所述抗體還可以使用熒光發射金屬如152eu或者其它鑭系元素進行可檢測標記。這些金屬可以使用如二亞乙基三胺五乙酸(dtpa)或者乙二胺四乙酸(edta)的金屬螯合基團附著到所述抗體上。將多種部分與抗體綴合的技術是熟知的,例如參見arnon等,“monoclonalantibodiesforimmunotargetingofdrugsincancertherapy”,inmonoclonalantibodiesandcancertherapy;reisfeld等,(eds.),pp.243-56(alanr.liss,inc.(1985);hellstrom等,“antibodiesfordrugdelivery”,incontrolleddrugdelivery(2nded.);robinson等,(eds.),marceldekker,inc.,pp.623-53(1987);thorpe,“antibodycarriersofcytotoxicagentsincancertherapy:areview”,inmonoclonalantibodies'84:biologicalandclinicalapplications,pincheraetal.(eds.),pp.475-506(1985);“analysis,results,andfutureprospectiveofthetherapeuticuseofradiolabeledantibodyincancertherapy”,inmonoclonalantibodiesforcancerdetectionandtherapy;baldwin等,(eds.),academicpresspp.303-16(1985)和thorpe等,“thepreparationandcytotoxicpropertiesofantibody-toxinconjugates”,immunol.rev.(52:119-58(1982))。
制備方法
在一些實施方案中,本公開提供了制備一種組合物的方法,所述組合物包含雙特異性抗體(msbody)和細胞毒性免疫細胞。
質粒pcho1.0-herceptinhl-kkw和pcho1.0-hygro-l2k-ldy用于表達her2×cd3msbody,并且質粒pcho1.0-抗ep-camhl-kkw和pcho1.0-hygro-l2k-ldy用于表達ep-cam×cd3(l2k)msbody。根據制造商的說明書,用maxcytestx(maxcyte)轉染cho-s細胞,并在37℃、含5%(體積/體積)co2的潮濕培養箱中以135rpm培養14天。通過4500×g離心收獲上清液并用0.22μm濾膜滅菌。基于制造商的手冊,通過蛋白a親和層析(rproteinaff;gehealthcare)、fabaffinitykbp瓊脂糖高流動樹脂(5ml體積,acrobiosystems公司)和sp陽離子交換層析柱提純抗體。使用ym-30kd超濾膜替換pbs緩沖洗脫液蛋白質。通過在280nm處的uv吸光度測定純化的igg的濃度(計算每種蛋白質的特異性誘導系數)。
用ficoll-histopaque(histopaque-1077,sigma)分離外周血單核細胞(pbmc)。第1天,在含1000iu/mlifn-γ和2%自血清的基礎離體培養基中培養cik細胞。第2天,將2.5ng/ml抗人cd3ε,25iu/mlil-2,0.02ng/mlil-1α加入該培養基中。除非另有說明,否則cik細胞在離體混合物中刺激14天。
制備抗體的方法是本領域熟知的并且已在本文中描述。在某些實施方案中,本公開的抗原結合多肽的可變區和恒定區均是完全人的。完全人抗體可以使用本領域描述的和本文描述的技術制備。例如,針對特異性抗原的完全人抗體可以通過將所述抗原施用于轉基因動物來制備,該轉基因動物已經過修飾以產生響應于抗原攻擊的抗體,但其內源基因座已經失能。可用于制備此類抗體的示例性技術描述于美國專利nos:6,150,584、6,458,592、6,420,140,其整體通過引用并入本文。
在某些實施方案中,所述制備的抗體不會在待治療動物(例如人)中引起有害的免疫應答。在一個實施方案中,使用本領域公認的技術修飾本公開的抗原結合多肽、變體或者其衍生物以降低它們的免疫原性。例如,抗體可以是人源化的、靈長類化的、去免疫的或者可以制備的嵌合抗體。這些類型的抗體衍生自保留或者基本上保留親本抗體的抗原結合特性但在人類中具有較低的免疫原性非人抗體,通常為鼠或者靈長類抗體。這可以通過多種方法實現,包括(a)將整個非人可變結構域接枝到人恒定區以產生嵌合抗體;(b)將一個或多個非人互補決定區(cdr)的至少一部分接枝到人框架和具有或者不具有關鍵框架殘基保留的恒定區;或者(c)移植所述整個非人可變結構域,但通過表面殘基替換,用人樣區段“隱藏”它們。這些方法公開于morrison等,proc.natl.acad.sci.usa57:6851-6855(1984);morrison等,adv.immunol.44:65-92(1988);verhoeyen等,science239:1534-1536(1988);padlan,molec.immun.25:489-498(1991);padlan,molec.immun.31:169-217(1994)及美國專利nos:5,585,089、5,693,761、5,693,762和6,190,370,其整體通過引用并入本文。
去免疫還可以用于降低抗體的免疫原性。如本文所用,術語“去免疫”包括改變抗體以修飾t細胞表位(例如參見國際申請公開nos:wo/9852976a1和wo/0034317a2)。例如,分析來自起始抗體的可變重鏈和可變輕鏈序列以及來自每個v區的人類t細胞表位“圖譜”顯示:創建與互補決定區(cdr)和其他關鍵殘基在序列上相關的表位的位置。分析來自所述t細胞表位圖譜的單個t細胞表位,以鑒定具有改變終抗體活性的低風險的替代性氨基酸取代。設計一系列包含氨基酸取代的組合的可變重鏈和可變輕鏈序列并且這些序列隨后并入一系列結合多肽中。通常,產生12至24個變體抗體并測試其結合和/或功能。然后將包含修飾的可變區和人恒定區的完整的重鏈和輕鏈基因克隆到表達載體中,并且隨后將該質粒導入細胞系以產生完整抗體。然后在合適的生物化學和生物測定中比較該抗體,并且鑒定最佳變體。
本公開的抗原結合多肽的結合特異性可以通過體外測定法,例如免疫沉淀、放射免疫測定(ria)或酶聯免疫吸附測定(elisa)來確定。
或者,描述用于生產單鏈單元的技術(美國專利no:4,694,778;bird,science242:423-442(1988);huston等,proc.natl.acad.sci.usa55:5879-5883(1988)以及ward等,nature334:544-554(1989))可適于產生本公開的單鏈單元。通過氨基酸橋連接重鏈和輕鏈片段的fv區形成單鏈單元,產生單鏈融合肽。還可以使用在大腸桿菌中組裝功能性fv片段的技術(skerra等,science242:1038-1041(1988))。
可用于產生單鏈fvs(scfvs)和抗體的技術實例包括那些描述于:美國專利nos:4,946,778和5,258,498;huston等,methodsinenzymology203:46-88(1991);shu等,proc.natl.sci.usa90:1995-1999(1993)和skerra等,science240:1038-1040(1988)。對于一些用途,包括人體內抗體的體內使用和體外檢測測定,可優選使用嵌合抗體、人源化抗體或者人抗體。嵌合抗體是其中抗體的不同部分衍生自不同動物物種的分子,例如具有衍生自鼠單克隆抗體的可變區和人免疫球蛋白恒定區的抗體。用于產生嵌合抗體的方法是本領域已知的。例如參見,morrison,science229:1202(1985);oi等,biotechniques4:214(1986);gillies等,j.immunol.methods125:191-202(1989);美國專利nos:5,807,715、4,816,567和4,816397,其整體通過引用并入本文。
人源化抗體是來源于非人物種抗體的抗體分子,其與具有來自非人物種的一個或多個互補決定區(cdr)和來自人免疫球蛋白分子的框架區所需的抗原結合。通常,來自cdr供體抗體的相應殘基將取代人框架區中的框架殘基以改變、優選改善抗原結合性。這些框架取代通過本領域熟知的方法鑒定,例如通過模擬cdr和框架殘基間的相互作用以鑒定對抗原結合重要的框架殘基和通過序列比較以鑒定在特定位置不尋常的框架殘基。(例如參見,queen等,美國專利no:5,585,089;riechmann等,nature332:323(1988),其整體通過引用并入本文。)抗體可以使用本領域已知的多種技術來人源化,例如cdr移植(ep239,400;pct公布:wo91/09967;美國專利nos:5,225,539、5,530,101和5,585,089)、鑲飾或表面重修(ep592,106;ep519,596;padlan,molecularimmunology28(4/5):489-498(1991);studnicka等,proteinengineering7(6):805-814(1994);roguska.等,proc.natl.sci.usa91:969-973(1994))和鏈改組(美國專利no:5,565,332,其整體通過引用并入本文)。
完全人抗體特別適用于人類患者的治療性治療。人抗體可以通過本領域已知的多種方法制備,包括使用來源于人免疫球蛋白序列的抗體文庫的噬菌體展示方法。也參見美國專利nos:4,444,887和4,716,111和pct公開:wo98/46645、wo98/50433、wo98/24893、wo98/16654、wo96/34096、wo96/33735和wo91/10741,其各自全部內容通過引用并入本文。
還可以使用不能表達功能性內源免疫球蛋白但可表達人免疫球蛋白基因的轉基因小鼠產生人抗體。例如人重鏈和輕鏈免疫球蛋白基因復合物可以隨機引入或通過同源重組引入小鼠胚胎干細胞。或者,除了人重鏈和輕鏈基因外,可以將人可變區/恒定區和多樣性區引入小鼠胚胎干細胞。小鼠重鏈和輕鏈免疫球蛋白基因可以與通過同源重組引入的人免疫球蛋白基因座分開或者同時呈現非功能性。特別地,jh區的純合缺失防止內源性抗體的產生。擴增所述修飾的胚胎干細胞并且顯微注射到胚泡中以產生嵌合體小鼠。然后將所述嵌合小鼠繁殖以產生表達人抗體的純合后代。以正常方式用選定的抗原(例如所需目標多肽的所有或者一部分)免疫轉基因小鼠。針對抗原的單克隆抗體可以使用常規雜交瘤技術從免疫的、轉基因的小鼠獲得。由所述轉基因小鼠攜帶的人免疫球蛋白轉基因在b細胞分化期間重排,并且隨后經歷類別轉換和體細胞突變。因此,使用這種技術產生治療上有用的igg,iga,igm和ige抗體是可能的。關于這種用于產生人抗體的技術的概述,參見lonbergandhuszarint.rev.immunol.73:65-93(1995)。關于這種用于產生人抗體和人單克隆抗體的技術的詳細討論和用于產生此類抗體的方案,例如參見,pct公開:wo98/24893、wo96/34096、wo96/33735;美國專利nos:5,413,923、5,625,126、5,633,425、5,569,825、5,661,016、5,545,806、5,814,318和5,939,598,其整體通過引用并入本文。此外,可以使用諸如abgenix,inc.(freemont,calif.)和genpharm(sanjose,calif.)公司來提供針對選定抗原的人抗體,所述人抗體使用與上述技術類似的技術。
識別選定表位的完全人抗體還可以使用稱為“引導選擇”(guidedselection)的技術產生。在該方法中,使用選定的非人單克隆抗體(例如,小鼠抗體)來指導完全人類抗體識別相同表位的選擇性。(jespersetal.,bio/technology72:899-903(1988)。還參見美國專利no:5,565,332,其整體通過引用并入本文)。
在另一個實施方案中,使用常規程序(例如通過使用能夠特異性結合編碼鼠抗體的重鏈和輕鏈的基因的寡核苷酸探針)可以容易地分離和測序編碼所需單克隆抗體的dna。所述分離的和亞克隆的雜交瘤細胞作為這種dna的優選來源。一旦分離,該dna可以置于表達載體中,然后將其轉染到原核或者真核宿主細胞中,例如不另外產生免疫球蛋白的大腸桿菌細胞、猿cos細胞、中國倉鼠卵巢(cho)細胞或者骨髓瘤細胞。更具體地,所述分離的dna(其可以如本文所述合成)可用于克隆用于制造抗體的恒定區和可變區的序列,如newman等,1995年1月25日提交的美國專利no:5,658,570中描述,其通過引用并入本文。基本上,這需要從選定的細胞中提取rna,轉化為cdna,并且使用ig特異性引物通過pcr來擴增。適用于該目的的引物還描述于美國專利no:5,658,570。如下面更詳細討論的,表達所需抗體的轉化細胞可相對大量生長以提供免疫球蛋白的臨床和商業供應。
另外,使用常規重組dna技術,本公開的抗原結合多肽的一個或者多個cdr可以插入框架區內,例如插入人框架區中以人源化非人抗體。所述框架區可以是天然存在的或者共有框架區,并且優選人框架區(例如參見,chothia等,j.mol.biol.278:457-479(1998),關于人框架區的列表)。優選地,通過框架區和cdr的組合產生的多核苷酸編碼與所需多肽(例如light)的至少一個表位特異性結合的抗體。優選地,可以在框架區內進行一個或者多個氨基酸取代,并且優選地,所述氨基酸取代增強了抗體與其抗原的結合。另外,此類方法可用于使參與鏈內二硫鍵的一個或多個可變區半胱氨酸殘基發生氨基酸取代或者缺失,以產生缺乏一個或者多個鏈內二硫鍵的抗體分子。所述多核苷酸的其他改變包括在本公開內容和本領域技術范圍內。
此外,可使用通過剪接來自具有適當抗原特異性的小鼠抗體分子的基因以及來自具有適當生物學活性的人抗體分子的基因來開發用于產生“嵌合抗體”的技術(morrison等,proc.natl.acad.sci.usa:851-855(1984);neuberger等,nature372:604-608(1984);takeda等,nature314:452-454(1985))。如本文所用,嵌合抗體是其中不同部分衍生自不同動物物種的分子,例如具有衍生自鼠單克隆抗體的可變區和人免疫球蛋白恒定區的那些。
另一種用于產生重組抗體的高效方法由newman,biotechnology10:1455-1460(1992)公開。具體地,該技術導致包含猴可變結構域和人恒定序列的靈長類化抗體的產生。該參考文獻其整體通過引用并入本文。此外,該技術還描述于共同轉讓的美國專利nos:5,658,570、5,693,780和5,756,096,其各自通過引用并入本文。
或者,可以使用本領域技術人員熟知的技術選擇和培養產生抗體的細胞系。這樣的技術描述于各種實驗室手冊和主要出版物中。在這方面,currentprotocolsinimmunology,coligan等,eds.,greenpublishingassociatesandwiley-interscience,johnwileyandsons,newyork(1991)中描述了適用于本公開如下所述的技術,其整體包括補充通過引用并入本文。
另外,本領域技術人員已知的標準技術可用于在編碼本公開的抗體的核苷酸序列中引入突變,包括但不限于定點誘變和pcr介導的導致氨基酸取代的誘變。優選地,相對于參考的可變重鏈區cdr-h1、cdr-h2、cdr-h3和可變輕鏈區cdr-l1、cdr-l2或者cdr-l3,所述變體(包括衍生物)編碼少于50個氨基酸取代、少于40個氨基酸取代、少于30個氨基酸取代、少于25個氨基酸取代、少于20個氨基酸取代、少于15個氨基酸取代、少于10個氨基酸取代、少于5個氨基酸取代、少于4個氨基酸取代、少于3個氨基酸取代或者少于2個氨基酸取代。或者,可以沿著編碼序列的全部或部分隨機引入突變,例如通過飽和誘變,并且可以篩選所得突變體的生物活性以鑒定保留活性的突變體。
在一些實施方案中,抗體模擬物用作抗原結合部分。抗體模擬物使用非免疫球蛋白蛋白支架作為抗體可變區的替代蛋白質框架。如本文所定義,抗體模擬物是包含適于特異性或隨機序列變異的一個或者多個區域(即,環區域)的多肽,使得所述抗體模擬物與目的抗原特異性結合(例如在細胞毒性免疫細胞表面上表達的抗原,例如cd2、cd3、cd4、cd5、cd8、cd11b、cd14、cd16a、cd45、cd56)。非限制性示例性抗體模擬物可以包括基于脂籠蛋白(lipocalins)的anticalins并且描述于weissandlowman,chembiol.,7(8):177-184(2000);skerra,j.biotechnol.74(4):257-275和wo99/16873;具有纖連蛋白iii型結構域和至少一個隨機化環的多肽描述于例如wo01/64942和美國專利no:6,818,418;具有p-夾心結構的多肽描述于wo00/60070;以及由兩個或者更多個單體結構域組成的非糖基化單鏈多肽,其可以分別結合包括通過接頭連接的蛋白質的任何類型的靶分子,描述于美國申請系列nos:10/133,128和10/871,602。
在美國申請系列nos.10/133,128和no.10/871,602中描述的具有非糖基化單鏈多肽的單體結構域的抗體模擬物與抗體的互補決定區(cdr)不同。與抗體不同,所述抗體模擬多肽能夠獨立折疊、形成熱穩定性的穩定結構。例如,所述多肽在95℃下穩定至少10分鐘,而結合親和力沒有明顯的損失。所述單體結構域的其他特征包括低免疫原性、低毒性、足以穿透皮膚或其它組織的小尺寸以及一系列體內半衰期和穩定性。
可以產生針對由本文所述的第二抗原結合部分結合的抗原的抗體模擬物。例如,可以使用本領域已知的方法分析與細胞毒性免疫細胞表面上的抗原結合的抗體,例如抗體-抗原相互作用的三維晶體結構分析,以鑒定對抗原結合至關重要的特異性殘基。一旦鑒定了這些殘基,可對所述抗體模擬物的環區進行定點誘變,使得該環形成所述第二抗原結合部分的結合口袋。這樣的修飾描述于例如,vogtandskerra,chembiochem.5(2):191-9(2004)。
lipovsek等(美國專利nos.6,818,418和7,115,396)公開了特征為纖連蛋白或者纖連蛋白樣支架和至少一個可變環的抗體模擬物,稱為adnectin。這些基于纖連蛋白的抗體模擬物顯示出許多天然或工程抗體的相同的期望特征,包括對靶向配體的高親和力和特異性。此外,這些基于纖連蛋白的抗體模擬物相對于抗體和抗體片段顯示出某些益處。例如,這些抗體模擬物因天然的可折疊性和穩定性而不依賴于二硫鍵,并且因此在通常會分解抗體的條件下是穩定的。
beste等(proc.natl.acad.sci.u.s.a.(1999)96(5):1898-1903)公開了基于脂籠蛋白支架(anticalintm)的抗體模擬物。脂籠蛋白由在蛋白質的末端具有四個高變環的β-桶組成。beste等對所述環進行隨機誘變并且選擇與,例如熒光素結合。三個變體顯示與熒光素的特異性結合,以及一個變體顯示出與抗熒光素抗體的結合相似性。進一步的分析顯示:所有的隨機位置是可變的,這表明anticalintm將適合用作抗體的替代物。anticalintm是通常長度為160至180個殘基的小的單鏈多肽,這提供了若干個優于抗體的優點,包括降低生產成本、提高儲存期間的穩定性和降低免疫反應。
hamilton等(美國專利no:5,770,380)公開了合成的抗體模擬物,該模擬物使用杯芳烴的剛性、非肽有機支架連接多個可變肽環作為結合位點。所述肽環相對于彼此幾乎從杯所述芳烴的同一側突出。由于這種幾何確認,所有所述環都可用于結合從而增加與配體的結合親和力。然而,與其他抗體模擬物相比,所述基于杯芳烴的抗體模擬物不僅僅由多肽組成,并因此不易受到蛋白酶的攻擊,并且在極端環境條件下相對穩定和具有長的壽命。此外,由于所述抗體模擬物的相對小的尺寸,其不太可能產生免疫原性應答。
murali等(cell.mol.biol.(2003)49(2):209-216)公開了將抗體還原成更小的肽模擬物的方法,稱為“抗體樣結合肽模擬物”,其還可以用作具有本公開的抗體的替代物。silverman等(nat.biotechnol.(2005)23:1556-1561)公開了融合蛋白,其是包含稱為“avimers”的多個結構域的單鏈多肽。通過體外外顯子改組和噬菌體展示從人細胞外受體結構域發育,所述avimer是一類結合蛋白,對于靶分子,其親和性和特異性與抗體有些相似。與單個表位結合蛋白相比,這些所得的多結構域蛋白可以表現出增強的親和力(在一些情況下亞納摩爾(sub-nm))和特異性。關于avimers的構建和使用的其他細節可發現于美國專利公開nos.2004/0175756、2005/0048512、2005/0053973、2005/0089932和2005/0221384。
除了非免疫球蛋白框架外,在包含rna分子和非天然寡聚體(例如蛋白酶抑制劑、苯并二氮雜類、嘌呤衍生物和bb-轉角模擬物)的化合物中也已經模擬了抗體性質,作為抗原結合部分,所有這些化合物都適用于本發明。
治療方法
如本文所述,本公開提供了治療包括癌癥患者的患者的方法,通過:從所述患者獲得外周血淋巴細胞(pbl)樣品;用抗cd3抗體,ifn-γ和il-2孵育所述pbl以獲得cik細胞;用雙特異性抗體武裝cik細胞,其中每個雙特異性抗體包含對腫瘤抗原具有抗原結合特異性的第一抗原結合部分和與所述cik細胞結合的第二抗原結合部分,并且施用所述具有結合的雙特異性抗體武裝的cik細胞到有需要的患者。本公開的所述抗原結合多肽、變體或者衍生物可以用于與癌癥或者傳染病相關的某些治療和診斷方法中。
本公開進一步涉及基于msbody和基于細胞的療法,其涉及向患者(例如動物、哺乳動物和人)施用本公開的所述雙特異性抗體和所述細胞毒性免疫細胞的所述組合物,用于治療一種或多種本文所述的病癥或者疾病。本公開的治療性化合物,包括但不限于本公開的抗體(包括如本文所述的變體及其衍生物)和編碼本公開的抗體(包括如本文所述的變體及其衍生物)的核酸或者多核苷酸。
本公開的所述雙特異性抗體和所述細胞毒性免疫細胞的所述組合物還可以用于治療、抑制或者預防包括惡性疾病、紊亂或與這樣的疾病或紊亂相關的癥狀,例如與增加的細胞存活或者細胞凋亡的抑制相關的疾病,例如癌癥(例如濾泡淋巴瘤,具有p53突變的癌癥和激素依賴性腫瘤包括但不限于結腸癌、心臟腫瘤、胰腺癌、黑素瘤、成視網膜細胞、成膠質細胞瘤、肺癌、腸癌、睪丸癌、胃癌、成神經細胞瘤、粘液瘤,肌瘤、淋巴瘤、內皮瘤、成骨細胞瘤、破骨細胞瘤、骨肉瘤、軟骨肉瘤,腺瘤、乳腺癌、前列腺癌、卡波西肉瘤和卵巢癌);自身免疫性疾病(例如多發性硬化、斯耶格倫綜合征、格雷夫斯病、橋本甲狀腺炎、自身免疫性糖尿病、膽汁性肝硬化、貝切特病、克羅恩病、多發性肌炎、系統性紅斑狼瘡和免疫相關性腎小球腎炎、自身免疫性胃炎、自身免疫性血小板減少性紫癜和類風濕關節炎)和病毒感染(例如皰疹病毒、痘病毒和腺病毒);炎癥;移植物抗宿主病(急性和/或慢性);急性移植排斥和慢性移植排斥。本公開的抗原結合多肽、變體或其衍生物用于抑制癌癥的生長、進展和/或轉移,特別是上文或下文段落中列出的那些。
可以用本公開的所述抗體或者變體或者其衍生物治療、預防、診斷和/或預后的與增加的細胞存活相關的其它疾病或癥狀,包括但不限于惡性腫瘤的進展和/或轉移和相關病癥,例如白血病(包括急性白血病(例如急性淋巴細胞性白血病、急性骨髓性白血病(包括成髓細胞、早幼粒細胞、骨髓單核細胞、單核細胞和紅白血病))和慢性白血病(例如慢性骨髓性);真性紅細胞增多癥;淋巴瘤(例如霍奇金病和非霍奇金病);多發性骨髓瘤;瓦爾登斯特倫氏巨球蛋白血癥;重鏈病和實體瘤,包括但不限于肉瘤和癌如纖維肉瘤、粘液肉瘤、脂肪肉瘤、軟骨肉瘤、骨肉瘤、脊索瘤、血管肉瘤、內皮肉瘤、淋巴管肉瘤、淋巴管內皮肉瘤、滑膜瘤、間皮瘤、尤因氏瘤、平滑肌肉瘤、橫紋肌肉瘤、結腸癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鱗狀細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭狀癌、乳頭狀腺癌、囊腺癌、髓樣癌、支氣管癌、腎細胞癌、肝細胞瘤、膽管癌、絨毛膜癌、精原細胞瘤、胚胎癌、wilm's腫瘤、宮頸癌、睪丸腫瘤、肺癌、小細胞肺癌、膀胱癌、上皮癌、神經膠質瘤、星形細胞瘤、成神經管細胞瘤、顱咽管瘤、室管膜瘤、松果體瘤、成血管細胞瘤、聽神經瘤、少突膠質細胞瘤、腎母細胞瘤、黑素瘤、成神經細胞瘤和視網膜母細胞瘤。
本公開的所述抗體還可以用于通過靶向微生物和免疫細胞以實現微生物的消除來治療由微生物引起的感染性疾病或者殺死微生物。在一個方面,所述微生物是包括rna和dna病毒的病毒、革蘭氏陽性細菌、革蘭氏陰性細菌、原生動物或者真菌。
本公開的所述組合物可以用于通過用所述雙特異性抗體武裝激活的細胞毒性免疫細胞(例如cik細胞)來治療感染病原體的患者的方法。當施用于患者時,所述武裝的細胞毒性免疫細胞將靶向并消除病原體感染的細胞。示例性的細胞毒性免疫細胞包括但不限于cik細胞、t細胞、cd8+t細胞、活化的t細胞、單核細胞、nk細胞、nkt細胞、lak細胞、巨噬細胞和樹突細胞。可以用本公開的組合物治療的非限制性示例性病原體感染包括病毒、細菌、真菌和寄生病原體。
在一些實施方案中,所述病原體是病毒。可以用本公開的所述組合物治療的示例性非限制性病毒感染,包括巨細胞病毒(cmv)、eb病毒(ebv)、i型單純皰疹病毒(hsv-1)、ii型單純皰疹病毒(hsv-ii)、bk病毒(bkv)、甲型肝炎病毒(hsv-a)、乙型肝炎病毒(hsv-b)、丙型肝炎病毒(hsv-c)、流感病毒、水痘、腺病毒、牛瘟、鼻病毒、艾柯病毒、輪狀病毒、呼吸道合胞病毒、乳頭瘤病毒、乳多泡病毒、皰疹病毒、蟲媒病毒、漢坦病毒、柯薩基病毒、腮腺炎病毒、麻疹病毒、風疹病毒、脊髓灰質炎病毒、i型人免疫缺陷病毒(hiv-1)和ii型人類免疫缺陷病毒、任何小核糖核酸病毒、腸道病毒、杯狀病毒科病毒、諾沃克病毒組的任何病毒、披膜病毒、例如登革熱病毒、甲病毒、黃病毒、冠狀病毒、狂犬病病毒、馬爾堡病毒、埃博拉病毒、副流感病毒、正粘病毒、布尼亞病毒、沙粒病毒、呼腸孤病毒、輪狀病毒、皰疹病毒、人t細胞白血病病毒i型、人t細胞白血病病毒ii型、猴免疫缺陷病毒、慢病毒、多瘤病毒、細小病毒、人類皰疹病毒-6、cercophehebine皰疹病毒1(b病毒)和痘病毒。
可以通過使用本公開的所述組合物治療或者預防的細菌性疾病或病癥,包括但不限于由分枝桿菌立克次氏體、支原體、奈瑟氏菌屬(例如腦膜炎奈瑟氏球菌和淋病奈瑟氏球菌)、軍團菌、霍亂弧菌、鏈球菌、例如肺炎鏈球菌、白喉棒狀桿菌、破傷風桿菌、百日咳桿菌、嗜血桿菌(例如流感嗜血桿菌)、衣原體屬、腸毒性大腸桿菌和炭疽芽孢桿菌(炭疽)引起的那些。
可以通過使用本公開的所述組合物治療或預防的真菌疾病或病癥,包括但不限于卡氏肺孢子蟲或者曲霉菌。
可以通過使用本公開的所述組合物治療或預防的原生動物疾病或病癥,包括但不限于瘧原蟲、艾美球蟲、利什曼原蟲和錐蟲。
任何特定患者的具體劑量和治療方案將取決于多種因素,包括所用的特定抗原結合多肽、變體或其衍生物、所述患者的年齡、體重、一般健康狀況、性別和飲食,以及施用時間、排泄速率、藥物組合以及所治療的特定疾病的嚴重性。醫療護理人員對這些因素的判斷在本領域的普通技術范圍內。該量還將取決于待治療的個體患者、施用途徑、制劑類型、所使用的化合物的特性、疾病的嚴重性和期望的效果。使用的量可以通過本領域公知的藥理學和藥代動力學原理確定。
施用本公開的所述雙特異性抗體和所述細胞毒性免疫細胞的所述組合物的方法,包括但不限于真皮內、肌內、腹膜內、靜脈內、皮下、鼻內、硬膜外和口服途徑。所述組合物可以通過任何方便的途徑施用,例如通過輸注或者彈丸注射、通過上皮或者粘膜皮膚內層(例如口腔粘膜、直腸和腸粘膜等)的吸收并且可以與其它生物活性劑一起施用。因此,本公開的所述組合物可以口服、直腸、胃腸外、腦池內、陰道內、腹膜內、局部(如通過粉末、軟膏、滴劑或透皮貼劑)、口腔、或口服或鼻腔噴霧施用。
如本文所用,術語“腸胃外”是指包括靜脈內、肌內、腹膜內、胸骨內、皮下和關節內注射和輸注的給藥模式。
給藥可以是全身或者局部的。此外,可能需要通過任何合適的途徑將本公開的所述組合物引入中樞神經系統,包括心室內和鞘內注射;心室內注射可以通過例如連接到儲器(例如ommaya儲器)的心室內導管來促進。還可以使用肺部給藥,例如通過使用吸入器或者霧化器以及具有霧化劑的制劑。
可能需要將本公開的所述組合物局部施用于需要治療的區域,這可以通過例如但不限于手術期間的局部輸注、局部施用(例如與手術后的傷口敷料結合)、通過注射、通過導管、通過栓劑的方式實現,或者通過植入物,所述植入物是多孔、無孔或凝膠狀材料,包括膜,例如硅橡膠膜或纖維。優選地,當施用本公開的蛋白質(包括抗體)時,必須謹慎使用蛋白質不吸收的材料。
在另一個實施方案中,本公開的所述雙特異性抗體和所述細胞毒性免疫細胞的所述組合物可以在囊泡,特別是脂質體中遞送(參見langer,1990,science249:1527-1533;treat等,inliposomesinthetherapyofinfectiousdiseaseandcancer,lopez-beresteinandfidler(eds.),liss,newyork,pp.353-365(1989);lopez-berestein,ibid.,pp.317-327;參見同上)。
在另一個實施方案中,本公開的所述組合物可以在控釋系統中遞送。在一個實施方案中,可以使用泵(參見sefton,1987,crccrit.ref.biomed.eng.14:201;buchwald等,1980,surgery88:507;saudek等,1989,n.engl.j.med.321:574)。在另一個實施方案中,可以使用聚合物材料(參見medicalapplicationsofcontrolledrelease,langerandwise(eds.),crcpres.,bocaraton,fla.(1974);controlleddrugbioavailability,drugproductdesignandperformance,smolenandball(eds.),wiley,newyork(1984);rangerandpeppas,j.,1983,macromol.sci.rev.macromol.chem.23:61;還參見levyetal.,1985,science228:190;during等,1989,ann.neurol.25:351;howard等,1989,j.neurosurg.71:105)。在另一個實施方案中,控釋系統可以放置在治療靶(即腦)附近,因此僅需要全身劑量的一部分(參見例如goodson,inmedicalapplicationsofcontrolledrelease,supra,vol.2,pp.115-138(1984))。其他控釋系統在langer的綜述(1990,science249:1527-1533)中討論。
可以通過標準臨床技術確定在治療、抑制和預防炎性、免疫或惡性疾病、病癥或癥狀中有效的本公開的所述雙特異性抗體和所述細胞毒性免疫細胞的組合物的量。此外,可以任選地使用體外測定以幫助鑒定最佳劑量范圍。在制劑中使用的精確劑量還將取決于施用途徑和疾病、病癥或癥狀的嚴重性,并且應當根據從業者的判斷和每個患者的情況來決定。有效劑量可以從源于體外或動物模型測試系統的劑量-反應曲線推測。
用于治療感染性或惡性疾病、癥狀或病癥的方法包括施用本公開的所述雙特異性抗體和所述細胞毒性免疫細胞的組合物,通常在可接受的動物模型中測試,用于所需的治療或者預防活性,然后用于人類。合適的動物模型包括轉基因動物,是本領域普通技術人員熟知的。例如,證明本文所述的抗原結合多肽的治療效用的體外測定法包括抗原結合多肽對細胞系或患者組織樣品的作用。所述抗原結合多肽對細胞系和/或組織樣品的作用可以使用本領域技術人員已知的技術(例如本文別處公開的測定法)來測定。根據本公開,可用于確定是否指示施用特異性抗原結合多肽的體外測定包括體外細胞培養測定,其中患者組織樣品在培養物中生長,并暴露于或以其它方式施用化合物,并且觀察這種化合物對組織樣品的影響。
在另一個實施方案中,本公開的所述組合物與抗腫瘤劑、抗病毒劑、抗細菌劑或者抗生素劑或者抗真菌劑組合施用。本領域已知的任何這些試劑可以在本公開的所述組合物中施用。
在另一個實施方案中,本公開的組合物與化療劑組合施用。可以與本公開的所述組合物一起施用的化療劑包括但不限于抗生素衍生物(例如多柔比星、博來霉素、柔紅霉素和更生霉素);抗雌激素(例如他莫昔芬);抗代謝藥(例如氟尿嘧啶、5-fu、甲氨蝶呤、氟尿苷、干擾素α-2b、谷氨酸、普卡霉素、巰嘌呤和6-硫鳥嘌呤);細胞毒素劑(例如卡莫司汀、bcnu、洛莫司汀、ccnu、阿糖胞苷、環磷酰胺、雌莫司汀、羥基脲、丙卡巴肼、絲裂霉素、白消安、順鉑和硫酸長春新堿);激素(例如甲羥孕酮、雌莫司汀磷酸鈉、乙炔雌二醇、雌二醇、醋酸甲地孕酮、甲基睪酮、己烯雌酚二磷酸酯,氯苯亞甲基和睪內酯);氮芥衍生物(例如美法侖、苯丁酸氮芥,氮芥(氮芥)和噻替派);類固醇和組合(例如倍他米松磷酸鈉)和其他(例如二碳嗪、天冬酰胺酶、米托坦、硫酸長春新堿、硫酸長春堿和依托泊苷)。
在另一個實施方案中,本公開的所述組合物與細胞因子組合施用。可以與本公開的所述組合物一起施用的細胞因子,包括但不限于il-2、il-3、il-4、il-5、il-6、il-7、il-10、il-12、il-13、il-15、抗-cd40、cd40l和tnf。
在另外的實施方案中,本公開的所述組合物與其它治療或預防方案(例如放射療法)組合施用。
組合物
本公開還提供藥物組合物。這樣的組合物包含有效量的雙特異性抗體(例如msbody)、cik細胞和可接受的載體。在具體實施方案中,術語“藥學上可接受的”是指由聯邦或者州政府的管理機構批準的或在美國藥典或其它公認的藥典中列出的用于動物,更特別是用于人的。此外,“藥學上可接受的載體”通常是任何類型的無毒固體、半固體或者液體填充劑、稀釋劑、包封材料或者制劑助劑。
分離細胞毒性免疫細胞
根據本公開,治療患有腫瘤或者感染病原體的患者的一個步驟是需要分離細胞毒性免疫細胞。在一些實施方案中,從包含可用雙特異性抗體的多克隆群體武裝的外周血單核細胞(即pbmc)或者外周血淋巴細胞(即pbl)的血液樣品中分離所述細胞毒性免疫細胞。在一些實施方案中,所述血液樣品獲自自體供體。在一些實施方案中,所述血液樣品獲自同系供體。在其它實施方案中,所述血液樣品獲自同種異體供體或者同種異體供體池。
一旦獲得所述血液樣品,將用雙特異性抗體武裝所述細胞毒性免疫細胞。從pbmc或者pml中分開和分離特定細胞類型的方法是本領域熟知的。細胞分離的合適方法包括使用percolltm梯度或者ficoll-hypaque的密度梯度離心。可以進一步純化細胞或者可以使用本領域熟知的陽性/陰性選擇技術選擇細胞亞群,例如使用負磁性免疫粘附,其使用針對存在于陰性選擇的細胞上的細胞表面標記物的單克隆抗體的混合物。根據抗體的選擇,可以使用該方法正向選擇所需的細胞。在一些實施方案中,使用熒光激活細胞分選(即facs)分離所需細胞群體。細胞分開和分離的其他方法是本領域技術人員熟知的。在一些實施方案中,洗滌所述分離的細胞毒性免疫細胞,并在合適的培養基中冷凍保存以備將來使用。
在一些實施方案中,所述細胞毒性免疫細胞可能需要在用雙特異性抗體武裝前被激活(例如t細胞)并且離體擴增。在離體或者體外活化和擴增細胞毒性免疫細胞的方法是本領域熟知的。下面描述了適用于本公開的產生和擴增cik細胞和激活t細胞的方法。
產生和擴增cik細胞
cik細胞的產生和擴增是本領域普通技術人員熟知的,例如如lu等所述(anovelpopulationofexpandedhumancd3+cd56+cellsderivedfromtcellswithpotentinvivoantitumoractivityinmicewithseverecombinedimmunodeficiency,j.immunol,1994,153(4):1687-1696),其需要幾天至幾周(例如21天)定時加入可溶性因子,例如ifn-γ、il-2和抗cd3抗體。
在一些實施方案中,所述抗cd3抗體是可從ortho-biotech(raritan,n.j.)獲得的okt3(莫羅單抗-cd3)或者可從bristol-meyerssquibb獲得的單克隆抗體g19-4。適用于本公開的離體激活t細胞的另外的抗體是本領域技術人員熟知的。
il-1,il-7和胸腺球蛋白的添加也已顯示有利于增加cik細胞的細胞毒性潛力(jiangj等,cytokine-inducedkillercellspromoteantitumorimmunity,j.translationalmed,2013,11:83;zollb等,generationofcytokine-inducedkillercellsusingexogenousinterleukin-2,-7or-12,cancerimmunolimmunother,1998,47(4):221-6)。在一些實施方案中,將所述擴增的cik細胞用10%胎牛血清和10%dmso翅片液氮冷凍保存,然后根據需要用于雙特異性抗體武裝的來解凍。
激活t細胞
在一些實施方案中,分離的t細胞通過用可溶性或者固定化的抗cd3抗體離體激活,描述于美國專利no:6,352,694和美國專利no:2003/0185823。然后在不存在外源性生長因子或者輔助細胞的情況下,通過用低劑量的il-2或il-7和il-15離體培養擴增所述分離的細胞。參見美國專利no:2003/0185823。
可以通過與固定在固體/不溶性支持物(1-5μg/ml)上的可溶性抗cd3抗體(約10-20ng/ml)或者抗cd3抗體離體接觸來激活t細胞。在一些實施方案中,所述抗cd3抗體是可從ortho-biotech(raritan,n.j.)獲得的okt3(莫羅單抗-cd3)或者可從bristol-meyerssquibb獲得的單克隆抗體g19-4。適用于本公開的離體激活t細胞的另外的抗體是本領域技術人員熟知的。
在一些實施方案中,通過用抗cd3抗體和抗cd28抗體共刺激t細胞進行其激活。適用于本發明的抗cd28抗體是murm9.3(abbott-biotech)。適用于本發明的另外的抗cd28抗體將是本領域技術人員熟知的并且可以從許多商業來源購買,包括rdidivisionoffitzgeraldindustriesintl.(actonmass.usa)和ebioscience(sandiegocalif.usa)。在一些實施方案中,使用與共固定在固體支持物上的具有1:1化學計量的抗cd3抗體(例如okt3)和抗cd28抗體(例如murm9.3)的共刺激來激活t細胞。
在通過用抗cd3刺激或者用抗cd3和抗cd28共刺激激活t細胞后,該細胞在低劑量il-2(10iu/ml至約500iu/ml)存在下擴增約14天。在一些實施方案中,所述細胞在低劑量il-7(25-100ng/ml),任選在il-15(25-100ng/ml)存在下擴增。所述細胞可以在il-2、il-7和/或il-15的任何組合,以及起到擴增活化的t細胞作用的重組細胞因子和非天然存在的重組細胞因子中擴增。例如,il-2可以單獨使用,或者與il-7和/或il-15組合使用。類似地,il-7可以單獨使用,或者與il-2和/或il-15組合使用。技術人員將理解,活化的t細胞可以在多種條件下擴增(參見例如fernandez-botran,advancedmethodsincellularimmunology(crcpress2000)。重組il-2(proleukinil-2)可以從chiron(emeryville,calif.)購買。il-7和il-15可以從prospec-tanytechnogeneltd.(rehovotisrael)購買。適用于本發明的白介素的其它來源是本領域技術人員熟知的。在一些實施方案中,將所述活化的和擴增的t細胞用10%胎牛血清和10%dmso翅片液氮冷凍保存,然后根據需要用于雙特異性抗體武裝的來解凍。
用雙特異性抗體武裝cik細胞
本文公開的所述組合物和方法提供對患有腫瘤或癌癥或感染病原體的患者的令人驚訝的有效治療,因為武裝所述細胞毒性免疫細胞以實現理想的治療效果所需的雙特異性抗體的濃度低。此外,本公開的所述雙特異性抗體能夠使所述細胞毒性免疫細胞接近腫瘤細胞或感染的細胞以使所述細胞毒性免疫細胞裂解腫瘤或感染的細胞。
在一些實施方案中,為了實現相同的期望效果,武裝所述細胞毒性免疫細胞所需的雙特異性抗體的濃度比本領域中其他組合物至少低一個數量級。在一些實施方案中,用每106個細胞毒性免疫細胞0.001ng至100ng的所述雙特異性抗體(例如msbody)的量武裝所述細胞(例如cik)。在一些實施方案中,用每106個細胞0.01ng至10ng的所述雙特異性抗體的量武裝所述細胞。在一些實施方案中,用每106個細胞0.1至1ng的所述雙特異性抗體的量武裝所述細胞。在一些實施方案中,用每106個細胞1ng的所述雙特異性抗體的量武裝所述細胞。在一些實施方案中,用于武裝所述細胞毒性免疫細胞的所述雙特異性抗體的濃度為100ng、50ng、40ng、30ng、20ng、15ng、10ng、5ng、4ng、3ng、2ng、1ng、0.5ng、0.1ng、0.05ng,0.01ng、0.005ng和0.001ng每106個細胞毒性免疫細胞。
在一些實施方案中,用0.001nm至1000nm的所述雙特異性抗體(例如msbody)武裝所述cik細胞以形成武裝活化cik細胞(acc)。在一些實施方案中,用0.01nm至100nm的所述雙特異性抗體(例如msbody)武裝所述cik細胞以形成acc。在一些實施方案中,用0.1nm至100nm的所述雙特異性抗體(例如msbody)武裝所述cik細胞以形成acc。在一些實施方案中,用1nm至100nm的所述雙特異性抗體(例如msbody)武裝所述cik細胞以形成acc。在一些實施方案中,用10nm至100nm的所述雙特異性抗體(例如msbody)武裝所述cik細胞以形成acc。在一些實施方案中,用50nm至100nm的所述雙特異性抗體(例如msbody)武裝所述cik細胞以形成acc。在一些實施方案中,用于形成acc的所述雙特異性抗體的濃度為1000nm、100nm、90nm、80nm、70nm、60nm、50nm、40nm、30nm、20nm、10nm、1nm、0.01nm和0.001nm。
所述細胞毒性免疫細胞(例如cik細胞)的武裝可以使用本領域已知的任何合適的方法進行。在一些實施方案中,例如,可以洗滌所述細胞并在理想的濃度重重懸浮,然后與特定濃度的雙特異性抗體一起孵育。經過一段時間合適的孵育,所述雙特異性抗體可與所述細胞毒性免疫細胞(例如cik細胞)結合,洗滌該細胞以除去任何未結合的結合分子。在一些實施方案中,將所述武裝的細胞毒性免疫細胞儲存在液氮中以備將來使用。參見,uberti等,clin.immunol.andimmunopath.(1994);ueda等,transplantation(1993)。在一些實施方案中,將所述武裝的細胞毒性免疫細胞以理想的濃度重懸于合適的培養基中并施用于有需要的患者。
在一些實施方案中,根據常規程序用藥物載體配制所述組合物。術語“載體”是指與治療劑一起施用的稀釋劑、佐劑、賦形劑或緩沖劑。這樣的藥物載體可以是無菌液體例如水和油,包括石油;動物;植物或合成來源的,例如花生油、大豆油、礦物油、芝麻油等。當靜脈內施用所述藥物組合物時,水是優選的載體。鹽溶液和葡萄糖水溶液和甘油溶液也可以用作液體載體,特別是用于可注射溶液。合適的藥物賦形劑包括淀粉、葡萄糖、乳糖、蔗糖、明膠、麥芽、大米、面粉、白堊、硅膠、硬脂酸鈉、單硬脂酸甘油酯、滑石粉、氯化鈉、脫脂乳、甘油、丙二醇等。如果需要,所述組合物還可以含有少量的潤濕劑或乳化劑,或ph緩沖劑例如乙酸鹽、檸檬酸鹽或磷酸鹽。抗菌劑如芐醇或對羥基苯甲酸甲酯;抗氧化劑如抗壞血酸或亞硫酸氫鈉;螯合劑如乙二胺四乙酸;還設想用于調節張力的試劑,例如氯化鈉或葡萄糖。這些組合物可以采取溶液、懸浮液、乳液、片劑、丸劑、膠囊、粉末、持續釋放制劑等形式。所述組合物可以使用傳統的粘合劑和載體例如甘油三酯配制成栓劑。口服制劑可以包括標準載體例如藥物級甘露醇、乳糖、淀粉、硬脂酸鎂、糖精鈉、纖維素、碳酸鎂等。合適的藥物載體的實例描述于e.w.martin的remington'spharmaceuticalsciences中,其通過引用并入本文。這樣的組合物將含有一定治療有效量的、優選以純化形式的抗原結合多肽,與合適量的載體一起,以提供用于對患者適當施用的形式。制劑應適合施用方式。親本制劑可以包封在安瓿、一次性注射器或由玻璃或塑料制成的多劑量小瓶中。
在一些實施方案中,根據常規方法將所述組合物配制為適合于靜脈內施用于人的藥物組合物。通常,用于靜脈內施用的組合物是在無菌等滲水性緩沖液中的溶液。如果需要,所述組合物還可以包括增溶劑和局部麻醉劑例如利多卡因,以減輕注射部位的疼痛。一般地,該成分以單位劑量形式單獨或混合在一起供應,例如作為干燥的凍干粉末或無水濃縮物在密封容器例如指示活性劑的量的安瓿或小袋中。當所述組合物通過輸注施用時,其可以用含有無菌藥物級水或鹽水的輸注瓶分配。當所述組合物通過注射施用時,可以提供含注射用無菌水或鹽水的安瓿,以便可以在施用之前混合成分。
藥學上可接受的鹽包括與陰離子如衍生自鹽酸、磷酸、乙酸、草酸、酒石酸等的陰離子形成的鹽,以及與陽離子形成的鹽,例如衍生自鈉、鉀、銨、鈣、氫氧化鐵、異丙胺、三乙胺、2-乙基氨基乙醇、組氨酸、普魯卡因等。
在一些實施方案中,本公開提供了包含所述組合物和使用說明書的試劑盒。
實施例
應當理解,雖然已經結合上述實施例描述了本公開,但是前面的描述和示例旨在說明而不是限制本公開的范圍。在本公開的范圍內的其他方面、優點和修改對于本公開所屬領域的技術人員將是顯而易見的。
本公開不限于所描述的具體實施方案的范圍,其旨在作為本公開的各個方面的單一說明,并且功能上等同的任何組合物或方法在本公開的范圍內。對本領域技術人員顯而易見的是,在不脫離本公開的精神或范圍的情況下,可以對本公開的方法和組合物進行各種修改和改變。因此,本公開旨在覆蓋本公開的修改和變化,只要它們落入所附權利要求及其等同物的范圍內。
本說明書中提及的所有出版物和專利申請通過引用并入本文,其程度如同每個單獨的出版物或專利申請被具體和單獨地指示通過引用并入。
實施例1.制備msbody
1.1構建表達載體
選擇pcho1.0作為克隆赫賽汀重鏈和輕鏈的表達載體。選擇pcho1.0-潮霉素,并用潮霉素標志物替換puriycin標志物作為表達載體構建l2k的單鏈抗體。如表1所示設計的引物與根據如表2所示的lc、hc、scfv-fc、migk前導序列的基因序列和載體的多克隆位點有適當的重疊。在之前的實驗中(參見pct/cn2012/08498,其整體通過引用并入本文)合成基因模板并亞克隆于pcdna3.1中。使用重疊pcr、用高保真dna聚合酶擴增片段lc、hc、scfv-fc。vl、cl、vh和ch1的pcr擴增條件包括在95℃下孵育5分鐘、隨后是在95℃下退化30秒的25個循環、在56℃下退火30秒、在72℃下延伸1分鐘、在72℃閉合延伸3分鐘。圖2描繪了顯示pcr產物的瓊脂糖凝膠。
表1.pcr引物序列
通過avrii/bstz17i或ecorv/paci的限制性消化制備線性化載體,通過瓊脂糖凝膠電泳來確認消化并通過nanodroptm儀器或其它方法測定濃度。將所述片段和線性化載體加入gibson
表2msbody的多肽和核酸序列
l2k-scfv單鏈融合肽(seqidno:1)
qvqlqqsgaelarpgasvkmsckasgytftrytmhwvkqrpgqglewigy
inpsrgytnynqkfkdkatlttdkssstaymqlssltsedsavyycaryy
ddhycldywgqgttltvssggggsggggsggggsqivltqspaimsaspg
ekvtmtcsasssvsymnwyqqksgtspkrwiydtsklasgvpahfrgsgs
gtsysltisgmeaedaatyycqqwssnpftfgsgtkleinrgaaaepksc
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshed
pevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeyk
ckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvk
gfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqg
nvfscsvmhealhnhytqkslslspgk
l2k-scfv單鏈融合肽核酸序列(seqidno:2)
caggtgcagctggtgcagagcggcggcggcgtcgtgcagccgggcaggtc
cctgagactgtcttgtaaggcttctggatacaccttcactagatacacaa
tgcactgggtcagacaggctcctggaaagggactcgagtggattggatac
attaatcctagcagaggttatactaactacaatcagaagtttaaggacag
attcacaatttctactgacaaatctaagagtacagccttcctgcagatgg
actcactcagacctgaggataccggagtctatttttgtgctagatattac
gatgaccactactgtctggactactggggccaaggtaccccggtcaccgt
gagctcaggaggcggcggttcaggcggaggtggaagtggtggaggaggtt
ctgatattcagatgacccagagcccgtcaagcttatctgcttctgtcgga
gacagagtcacaatcacatgttctgcttctagctctgtctcttacatgaa
ctggtatcagcagacacctggaaaggctcctaagcggtggatctacgaca
catctaagctcgcttctggagtcccttctagattctctggttctggctct
ggaacagactacacattcacaatctcttctctccaacctgaggacatcgc
tacatactactgccaacagtggtctagcaatcctttcacattcggacagg
gtaccaaactgcagatcacaagaggtgcggccgcagagcccaaatcttgt
gacaaaactcacacatgcccaccgtgcccagcacctgaactcctgggggg
accgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatct
cccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagac
cctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgc
caagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtca
gcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaag
tgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctc
caaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccat
cccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaa
ggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagcc
ggagaacaactacaagaccacgcctcccgtgctggactccgacggctcct
tcttcctctacagcaagctcaccgtggacaagagcaggtggcagcagggg
aacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacac
gcagaagagcctctccctgtctccgggtaaatga
單價單元的赫賽汀重鏈(seqidno:3)
evqlvesggglvqpggslrlscaasgfnikdtyihwvrqapgkglewvar
iyptngytryadsvkgrftisadtskntaylqmnslraedtavyycsrwg
gdgfyamdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvk
dyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqt
yicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkp
kdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyn
styrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepq
vytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppv
ldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
單價單元的赫賽汀重鏈,核酸序列(seqidno:4)
gaagtgcagctggtggaaagcggcggcggcctggtgcagccgggcggatc
cctgcgcctgagctgcgcggcgagcggctttaacattaaagatacctata
ttcattgggtgcgccaggcgccgggcaaaggcctggaatgggtggcgcgc
atttatccgaccaacggctatacccgctatgcggatagcgtgaaaggccg
ctttaccattagcgcggataccagcaaaaacaccgcgtatctgcagatga
acagcctgcgcgcggaagataccgcggtgtattattgcagccgctggggc
ggcgatggcttttatgcgatggattattggggccagggcaccctggtgac
cgtgagctcagcctccaccaagggcccatcggtcttccccctggcaccct
cctccaagagcacctctgggggcacagcggccctgggctgcctggtcaag
gactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgac
cagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctact
ccctcagcagcgtggtgaccgtgccctccagcagcttgggcacccagacc
tacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaa
agttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccag
cacctgaactcctggggggaccgtcagtcttcctcttccccccaaaaccc
aaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggt
ggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacg
gcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaac
agcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggct
gaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagccc
ccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacag
gtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcag
cctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagt
gggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtg
ctggactccgacggctccttcttcctctacagcaagctcaccgtggacaa
gagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgagg
ctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaa
tga
單價單元的赫賽汀輕鏈(seqidno:5)
diqmtqspsslsasvgdrvtitcrasqdvntavawyqqkpgkapklliys
asflysgvpsrfsgsrsgtdftltisslqpedfatyycqqhyttpptfgq
gtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkv
dnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqg
lsspvtksfnrgec
單價單元的赫賽汀輕鏈,核酸(seqidno:6)
gatattcagatgacccagagcccgtcaagcttaagcgcgagcgtgggcga
tcgcgtgaccattacctgccgcgcgagccaggatgtgaacaccgcggtgg
cgtggtatcagcagaaaccgggcaaagcgccgaaactgctgatttatagc
gcgagctttctgtatagcggcgtgccgagccgctttagcggcagccgcag
cggcaccgattttaccctgaccattagcagcctgcagccggaagattttg
cgacctattattgccagcagcattataccaccccgccgacctttggccag
ggtaccaaagtggaaattaaacgaactgtggctgcaccatctgtcttcat
cttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgt
gcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtg
gataacgccctccaatcgggtaactcccaggagagtgtcacagagcagga
cagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaag
cagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggc
ctgagctcgcccgtcacaaagagcttcaacaggggagagtgttag
單價單元的ep-cam重鏈(seqidno:7)
evqlleqsgaelvrpgtsvkisckasgyaftnywlgwvkqrpghglewigdifpgsgnihynekfkgkatltadkssstaymqlssltfedsavyfcarlrnwdepmdywgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvslwclvkgfypsdiavewesngqpennydttppvldsdgsfflysdltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
單價單元的ep-cam重鏈,核酸(seqidno:8)
gaggtgcagctgctcgagcagtctggagctgagctggtaaggcctgggacttcagtgaagatatcctgcaaggcttctggatacgccttcactaactactggctaggttgggtaaagcagaggcctggacatggacttgagtggattggagatattttccctggaagtggtaatatccactacaatgagaagttcaagggcaaagccacactgactgcagacaaatcttcgagcacagcctatatgcagctcagtagcctgacatttgaggactctgctgtctatttctgtgcaagactgaggaactgggacgagcctatggactactggggccaagggaccacggtcaccgtctcctccgcgtcgaccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtctacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgtggtgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacgataccacgcctcccgtgctggactccgacggctccttcttcctctacagcgatctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatga
單價單元的赫賽汀輕鏈(seqidno:9)
elvmtqspssltvtagekvtmsckssqsllnsgnqknyltwyqqkpgqppklliywastresgvpdrftgsgsgtdftltissvqaedlavyycqndysypltfgagtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
單價單元的赫賽汀輕鏈,核酸(seqidno:10)
gagctcgtgatgacacagtctccatcctccctgactgtgacagcaggagagaaggtcactatgagctgcaagtccagtcagagtctgttaaacagtggaaatcaaaagaactacttgacctggtaccagcagaaaccagggcagcctcctaaactgttgatctactgggcatccactagggaatctggggtccctgatcgcttcacaggcagtggatctggaacagatttcactctcaccatcagcagtgtgcaggctgaagacctggcagtttattactgtcagaatgattatagttatccgctcacgttcggtgctgggaccaagcttgagatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgttag
1.2表達和純化
根據手冊,用endofreeplasmidgigakit(qiagen,12391)制備用于瞬時轉染的質粒。使用質粒pcho1.0-赫賽汀hl-kkw和pcho1.0-潮霉素-l2kscfv-fc-ldy表達her2×cd3msbody。使用質粒pcho1.0-抗-ep-camhl-kkw和pcho1.0-潮霉素-l2kscfv-fc-ldy表達ep-camxcd3msbody。根據制造商的說明書,用maxcytestx(maxcyte)轉染cho-s細胞。將轉染的cho-s細胞在37℃、5%(vol/vol)co2潮濕培養箱中以135rpm培養14天。通過2000*g離心收獲上清液并用0.22μm濾膜滅菌。通過蛋白a親和層析(rproteinaff;gehealthcare),fabaffinitykbpagarosehighflowresin(acrobiosystems公司,5ml體積)和sp陽離子交換層析柱(gehealthcare,10ml)純化抗體。使用ym-30kd超濾膜、用pbs緩沖液代替蛋白質的洗脫。通過在280nm處的uv吸光度測定純化的igg的濃度(計算每種蛋白質的特異性誘導系數)。
通過sds/page分析純化的蛋白質(圖3.a和b),分子量為約125kd。通過高性能尺寸排阻色譜法(hp-sec)測試批次的igg并顯示為至少95%單體(圖3.c和d),在體內使用的批次的內毒素水平為<1.1內毒素單位/mgigg。
1.3msbody的結合活性分析
使用sk-br-3和jurkat細胞測試her2×cd3msbody的cd3與her2的結合能力。收集3×105sk-br-3或jurkat細胞并與50μlpbs或160nm的赫賽汀或msbody的兩倍系列稀釋液一起孵育。約30分鐘后,用1%fbs/pbs洗滌細胞兩次,然后與2.5μlpe標記的抗人iggfc混合。將混合物在室溫下孵育30分鐘,再次用1%fbs/pbs洗滌細胞。然后在facs設備上對樣品進行檢查。如圖4a所示,赫賽汀(黑色虛線)和her2×cd3msbody(黑色實線)都與乳腺癌細胞sk-br-3結合。該結果表明msbody可以有效地結合表達her2的癌細胞。收集jurkat細胞,并與50μlpbs或160nml2k單克隆抗體或msbody的兩倍系列稀釋液一起孵育。由雙特異性配體(黑色實線)結合的jurkat細胞的豐度與l2k的(黑色虛線)一樣高(圖4b)。
收集3×105sw480或jurkat細胞以測試ep-cam×cd3msbody的結合活性。如圖5a所示,抗ep-cam單克隆抗體(黑色虛線)和ep-cam×cd3msbody(黑色實線)都與結腸癌細胞sw480結合。如圖5b所示,l2k單克隆抗體(黑色虛線)和ep-cam×cd3msbody(黑色實線)都與jurkat細胞結合。
實施例2.cik細胞培養以及細胞與細胞締合測定
收集來自健康供體的血液以分離外周血單核細胞(pbmc)和自身血清。所述血液在700g、室溫下離心20分鐘,收集上清液作為自血清,其余的是血沉棕黃層。通過ficoll-histopaque(來自sigma的histopaque-1077)從血沉棕黃層中分離pbmc。第1天,在含750iu/mlifn-γ和2%自血清的基礎離體培養基中培養cik細胞,第2天,將2.5ng/ml抗人cd3ε、25iu/mlil-2、0.02ng/mlil-1α加入該培養基中。除非另有說明,否則cik細胞在離體混合物中刺激生長14天。計數細胞并保持在1×106個細胞/ml。通過臺盼藍排除法(trypanblueexclusion)測定細胞的存活力。cik細胞與fitcmouseanti-humancd45(bd,bd555482)、ucht1peanti-humancd3(biolengend,300408)和cd56((pe/cy7anti-humancd56,biolegend318318)孵育(“武裝”)。使用流式細胞術測量細胞表型,并將其定量為與fl2相比,fl1的右上象限中陽性細胞的百分比。總群體具有43.0%cd3和cd56雙陽性(圖6),其是具有高殺傷效率的nkt細胞組。
對于msbody分子介導的共結合測定,用celltracecfse(sigma)標記sk-br-3細胞(her2陽性)。通過細胞膜標記試劑盒(sigma)用pkh26標記cik細胞(cd3陽性)。將細胞(3×105個細胞/ml)重懸于pbs中,并在不同量的msbody分子存在下以1:1的比例在室溫下混合30分鐘。通過流式細胞術測量共結合并且定量為與fl2相比,fl1的右上象限中陽性細胞的百分比,代表cfse和pkh26雙陽性群體(圖7),約27.5%的細胞是由msbody共結合的。
實施例3.her2×cd3武裝激活的cik細胞(acc)
在該實例中的msbody武裝激活的cik細胞在圖8中示出。收集3×105個cik細胞并與50μlpbs或者100nmmsbody的兩倍系列稀釋液一起孵育。約30分鐘后,用1%fbs/pbs洗滌細胞兩次,然后與2.5μlpe標記的抗人iggfc混合。將混合物在室溫下孵育30分鐘,再次用1%fbs/pbs洗滌細胞。然后在facs設備上對樣品進行檢查。
首先用5μmcfse對sk-br-3細胞(靶細胞)染色,然后以2×104個細胞/孔(100μl)接種在96孔中,然后用her2×cd3msbody武裝活化的cik細胞或在第2天將來自100nm的2倍系列稀釋濃度(效應細胞:e-t=5:1)的陰性對照higg和100ulacc(1×106acc/ml)加入靶細胞。24小時后收集細胞,用1ug/mlpi染色,然后用流式細胞術(fc500,beckmancoulter)計數。體外研究表明,her2×cd3msbody武裝的acc在0.01-1.25ug/1×106個細胞的濃度下可以充分地裂解乳腺癌細胞。圖9顯示了通過由her2×cd3武裝的acc介導的用于sk-br-3靶標的特異性細胞毒性的概述。
實施例4.her2×cd3和ep-cam×cd3acc的細胞毒性
使用sk-br-3細胞作為靶細胞,對于her2×cd3msbody、赫賽汀和l2k,以人igg作為對照,測量抗體誘導的細胞毒性。首先用5μmcfse對sk-br-3細胞(靶細胞)染色,然后以2×104個細胞/孔接種在96孔中,然后在第2天加入培養的cik(效應細胞:e-t=5:1)。同時,將等濃度的赫賽汀、l2k、msbody和人igg加入到細胞培養物中。24小時后收集細胞并用1ug/mlpi染色,然后用流式細胞術(fc500,beckmancoulter)計數。如果用cfse和pi雙重染色則計為死細胞。細胞死亡率的測量為死細胞與總細胞的比率。細胞毒性計算為測量的細胞死亡率和自然細胞死亡率之間的差異。結果示于圖10,其中與赫賽汀和l2k相比,msbody具有最高的細胞毒性。
通過使用人cik細胞作為效應細胞和ep-cam陽性人癌細胞系sw480作為靶細胞的流式細胞術測量重定向的細胞毒性。在14天的刺激生長后,通過在250grt下離心收集cik細胞。然后將細胞重懸于rpmi-1640完全培養基中并調節至4×106個細胞/ml。根據制造商的說明書(sigma-aldrich)用cfse染料對靶細胞染色。將等體積的靶標和效應細胞懸浮液混合并將150μl該懸浮液轉移到96孔板的每個孔中。加入50μlep-cam×cd3系列稀釋液或rpmi完全培養基(陰性對照)。除非另有說明,將板在37℃、5%co2加濕培養箱中孵育24小時或48小時。24小時或48小時后收集細胞,并用piat、以1ug/ml的終濃度染色,然后在facsfc500儀器(beckman,德國)上通過流式細胞術分析樣品。靶細胞裂解確定為由cfse和pi染色呈陽性的細胞的百分比。所有樣品重復進行。通過整合到graphpadprismversion5.0(graphpadsoftware,sandiego,ca)中的四級參數非線性擬合模型進行細胞毒性測定的數據分析。結果示于圖8。
實施例5.采用轉移異種移植腫瘤模型
動物,六(6)至八(8)周齡的nod-scid小鼠(nod.cb17-prkdcscid/ncr)獲自beijinghfkbioscienceco.ltd并且容納在湖北省食品藥品安全評價中心中央實驗室的屏障單元中。將5×106個nci-n87細胞、以終體積為0.1ml/小鼠注射到小鼠右脅腹中。在第1、3、6、9天通過靜脈內注射武裝活化cik。在研究期間,取出肝素化的血液樣品用于測定抗體血漿水平,其在預期范圍內。每3天測量腫瘤體積并由數字卡尺測量值計算為1/2×長度×寬度2(mm3)。結果表明武裝的cik細胞抑制腫瘤生長(圖11)。
實施例6.sw480人結腸癌異種移植模型
人異種移植模型中的所有動物實驗在來自beijinghfkbioscienceco.ltd的nod/scid小鼠中進行。將小鼠保持在無菌和標準化環境條件下(室溫20±1℃、相對濕度50±10%、12小時光:12小時暗節律)。他們接受高壓滅菌的食物和床上用品并隨意使用酸化(ph4.0)的飲用水。對它們進行滲漏測試并且僅使用igg水平低于100ng/ml的小鼠。將5×106個培養的cik細胞與5×106sw480結腸癌細胞混合,得到約1:1的有效e:t比。將cik和sw480混合物,以終體積為0.1ml/小鼠的量皮下注射到右脅腹中。一組動物僅注射sw480細胞以評估由cik效應細胞誘導的非特異性效應。對于最小殘留疾病模型中的治療組,在指示劑量為0.01、0.1、1mg/小鼠下、經sw480/cik接種1小時后,用msbody雙特異性抗體(epcam×cd3)或緩沖劑(pbs)靜脈內處理每組的6只動物,并在12天內重復處理4次。在建立的腫瘤模型中,當皮下生長腫瘤達到50-200mm3時,在第0天(陽性對照)和sw480接種后的第8天處理每組的8只動物并且處理重復2次。在指定日期用測徑器以兩個垂直維度測量腫瘤尺寸,并根據1/2×長度×寬度2(以mm3計)作為功效的相關性計算腫瘤體積。
除非另有定義,否則本文使用的所有技術和科學術語具有與本發明所屬領域的普通技術人員通常理解的相同含義。
本文示例性描述的本發明可以在不存在本文未具體公開的任何一個或多個元件,一個或多個限制的情況下適當地實施。因此,例如,術語“包含”,“包括”,“含有”等應當被廣泛地且無限制地理解。另外,本文中采用的術語和表達已經用作描述性而不是限制性術語,并且在使用這些術語和表達時并不意在排除所示和所描述的特征或其部分的任何等效物,而是認識到在本發明所要求保護的范圍內,各種修改是可能的。
因此,應當理解,本文提供的材料、方法和實施例是優選實施方案的代表、是示例性的,并且不意圖作為對本發明范圍的限制。
本文已廣泛且一般性地描述了本發明。一般公開內容中的每個較窄種類和亞類群也形成本發明的一部分。這包括本發明的一般性描述,不管所排除的材料是否在本文中具體描述,該描述具有從屬中移除任何主題的附帶條件或否定限制。
此外,本發明的特征或方面是根據馬庫什組描述的,本領域技術人員將認識到,本發明也因此根據馬庫什組的任何單個成員或亞組成員描述。
本文提及的所有出版物、專利申請、專利和其他參考文獻的整體通過引用明確地并入本文,其程度如同通過引用單獨地并入本文。在沖突的情況下,本說明書(包括定義)將控制。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 用于治療HBV感染和相關病癥的三特異性結合分子的制造方法與工藝
- 對磺胺類藥物具有特異性的固相微萃取纖維的制備方法與流程
- 一種檢測豬初乳中抗PEDV特異性IgA抗體的夾心ELISA試劑盒的制造方法與工藝
- 用于施用CD19xCD3雙特異性抗體的給藥方案的制造方法與工藝
- 雙特異性抗?VEGF/抗?ANG?2抗體及其在治療眼血管疾病中的應用的制造方法與工藝
- 特異性人EWS?FLI1融合蛋白抗體的制備方法及在制備尤文肉瘤診斷抗體試劑的應用與制造工藝
- 雙特異性四價抗體及其制造和使用方法與制造工藝
- 利用特異性揮發物篩選昆蟲相關嗅覺蛋白的方法與制造工藝
- 使用與表面偶聯的單特異性四聚抗體復合物組合物從樣品中分離出靶實體的方法與制造工藝
- 抗-WT1/HLA雙特異性抗體的制造方法與工藝
- 與CD56分子特異性結合的多肽及其應用的制造方法與工藝
- 用于治療HBV感染和相關病癥的三特異性結合分子的制造方法與工藝
- 對磺胺類藥物具有特異性的固相微萃取纖維的制備方法與流程
- 避免信號干擾的肌原纖維蛋白絲氨酸磷酸化水平的測定方法與流程
- 一種檢測豬初乳中抗PEDV特異性IgA抗體的夾心ELISA試劑盒的制造方法與工藝
- 用于施用CD19xCD3雙特異性抗體的給藥方案的制造方法與工藝
- 雙特異性抗?VEGF/抗?ANG?2抗體及其在治療眼血管疾病中的應用的制造方法與工藝
- 特異性人EWS?FLI1融合蛋白抗體的制備方法及在制備尤文肉瘤診斷抗體試劑的應用與制造工藝
- 活化人CD40的抗體和針對人PD?L1的抗體的組合療法的制造方法與工藝
- 雙特異性四價抗體及其制造和使用方法與制造工藝