舞茸靈芝茶及其制備方法與流程
本發明涉及一種保健茶的制備方法,特別是一種舞茸靈芝茶及其制備方法。
背景技術:
紅茶是中國六大茶類中最具影響力的茶類之一,中國是世界上最早生產和飲用紅茶的國家,早在明代初期(1368-1375年)中國就有生產紅茶的記載。大量的研究報道證實了紅茶色素的抗腫瘤、抗突變、抑制病原菌、抗病毒的作用,以及對心腦血管疾病等多方面的預防和治療作用。紅茶中含有的兒茶素和茶黃素的抗氧化活性甚至優于谷胱甘肽、抗壞血酸和生育酚。有研究表明,紅茶中所含的茶黃素的抗氧化活性不亞于綠茶中所含兒茶素,而且紅茶加工發酵過程中兒茶素向茶黃素的轉化并未顯著改變其清除自由基的活性。另有文獻報道,紅茶多酚具有抑制主動脈內皮細胞增殖的作用,具有抗腫瘤、防癌的功效。隨著紅茶保健功能的醫學證明和人們對健康意識的提高,加之其具有獨特的品質特征,紅茶也越來越受到世人的青睞。
靈芝為多孔菌科(polyporaceae)真菌赤芝(leyss.exfr.)karst.或紫芝g.sinensezhao,xuetzhang的干燥子實體。靈芝是祖國中醫藥寶庫中的珍品,素有“仙草”之譽。靈芝的子實體具有強烈的藥理學活性,有止痛、鎮靜、解毒的作用,可以抗腫瘤、調節免疫力、降低血糖,具有滋補強身、延年益壽的功效。靈芝的藥理成分非常豐富,其中有效成分包括靈芝多糖、三萜類化合物、氨基酸、蛋白質、生物堿以及微量元素等,各有效成分之間具有協同作用。
灰樹花(grifolafrondosa)隸屬擔子菌亞門,層菌綱,無隔擔子菌亞綱,非褶菌目,多孔菌科,樹花菌屬,又名貝葉多孔菌、栗子蘑、蓮花菌,日本俗稱舞茸。灰樹花是亞熱帶至溫帶森林中的大型真菌,具有獨特的芳香味,營養豐富,口味鮮美,且含有豐富的生物活性物質。近年來,國內外深入開展了作為生物反應調節劑的真菌多糖的研究,灰樹花多糖顯著的療效也逐漸被人們所認識。經過大量的化學和藥理分析發現,灰樹花多糖具有明顯的抗腫瘤,抗hiv病毒,改善免疫系統功能,調節血糖、血脂及膽固醇水平,降血壓作用,對防止癌細胞的生成和轉移、艾滋病、高血壓、肥胖癥、糖尿病以及免疫系統功能的紊亂都有一定的療效,且無任何毒副作用。因此,灰樹花是一種極具開發價值的珍貴食、藥用真菌。
保健茶是以茶為主,配有適量中藥,既有茶味,又有輕微藥味,并有保健治療作用的飲料。保健茶因富含茶葉營養成分、藥效成分,加以配佐原料特定成分相結合,又同現今國際上回歸大自然的思潮吻合,因而受到相當人群的歡迎。保健茶的研制,隨著社會的發展,科技的進步,不斷提高,各種保健茶如雨后春筍般涌現。但是目前的保健茶制造,不少都停留在照搬古方,或以某一茶類為原料,簡單用藥拼成,缺乏科學實驗、檢測分析,致使保健茶的聲譽受到影響。而且,市場上的保健茶種類繁多,功效各有側重,口味也大不相同。為滿足不同消費人群的需求,多一些保健茶的品種會更方便人們的選擇。
技術實現要素:
本發明的目的,是提供一種舞茸靈芝茶及其制備方法。本發明具有食用方便、口感合適,有效活性成分更容易被人體所吸收,能增強免疫力的特點,為保健茶提供了更多品種,便于消費者選用。
本發明是這樣實現的。舞茸靈芝茶,它是以下述重量配比的原料制成,
紅茶150份、
灰樹花提取物20-80份、
靈芝提取物80-20份。
前述的舞茸靈芝茶,其特征在于:它是以下述重量配比的原料制成,
紅茶150份、
灰樹花提取物25-80份、
靈芝提取物80-25份。
前述的舞茸靈芝茶,其特征在于:它是以下述重量配比的原料制成,
紅茶150份、
灰樹花提取物25-75份、
靈芝提取物75-25份。
前述舞茸靈芝茶的制備方法,按下述步驟制備;
a、紅茶滅菌、粉碎,得a品;
b、灰樹花提取物過篩,得b品;
c、靈芝提取物過篩,得c品;
d、將a品、b品和c品置于混合機中,混合后得d品;
e、將d品制粒得成品。
前述的舞茸靈芝茶制備方法中,所述的步驟a為,將紅茶采用co60輻照滅菌,輻照劑量6kgy,粉碎過80目篩,得a品;所述的步驟d為,將a品、b品和c品置于混合機中,混合28~35分鐘,得d品;所述的步驟e為,向d品中加入適量80%乙醇,混合均勻,通過14目篩制粒,再通過65℃烘干,控制水分≤10%,14目篩整粒,得e品。
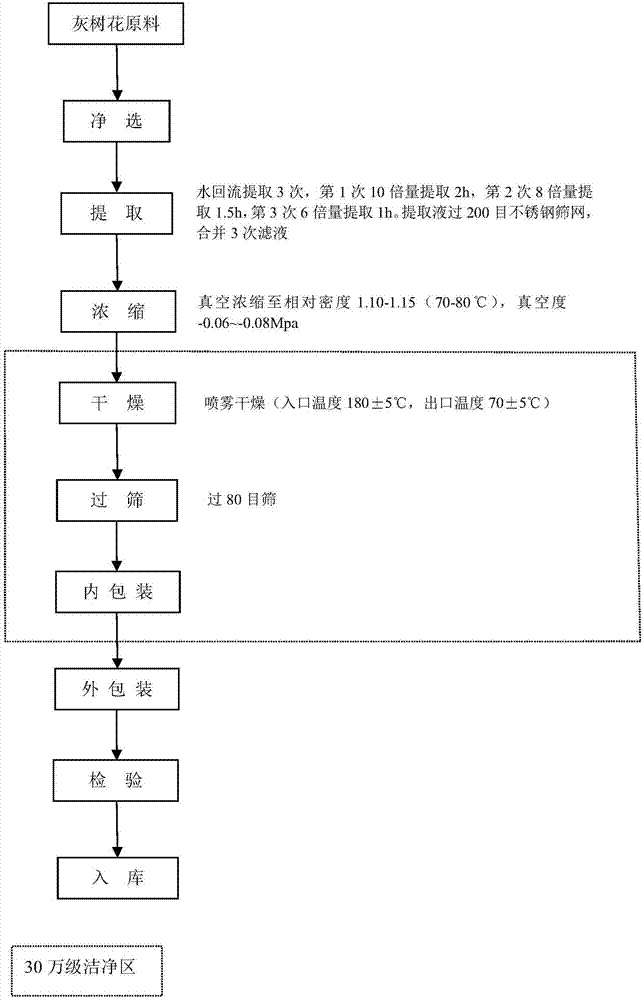
前述的舞茸靈芝茶制備方法中,所述的步驟b中的灰樹花提取物,按下述步驟制備:
b1、將灰樹花原料回流提取多次,提取液過篩合并,得b1品;
b2、將b1品濃縮得b2品;
b3、將b2品干燥過篩,得灰樹花提取物。
前述的舞茸靈芝茶制備方法中,所述的步驟b1為,將灰樹花原料凈選后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液過200目不銹鋼篩網,合并3次濾液,得b1品;所述的步驟b2為,將b1品真空濃縮至70℃-80℃下的相對密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;所述的步驟b3為,將b2品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得灰樹花提取物。
前述的舞茸靈芝茶制備方法中,所述的步驟c中的靈芝提取物,按下述步驟制備:
c1、將靈芝子實體進行粉碎,得c1品;
c2、將c1品回流提取多次,提取液過篩合并,得c2品;
c3、將c2品濃縮,得c3品;
c4、將c3品干燥過篩,得靈芝提取物。
前述的舞茸靈芝茶制備方法中,所述的步驟c2為,將c1品通過水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目篩過濾,合并濾液,得合并濾液c2品;所述的步驟c3為,將c2品減壓濃縮,真空度-0.06~-0.08mpa,濃縮至70℃-80℃下的相對密度1.05-1.15,得濃縮液c3品;所述的步驟c4為,將c3品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得靈芝提取物。
與現有技術比較,本發明在紅茶中加入靈芝與灰樹花的提取物,使靈芝、灰樹花和茶葉的有效活性成分充分的結合在一起,并且使產品中的有效活性成分更容易被人體所吸收,更加豐富茶的保健功能;本發明的靈芝養生紅茶不僅具有紅茶的口感和保健的優點,還結合了靈芝和灰樹花的藥用功能,具有護肝、養胃、寧心安神、明目、降血壓、降血脂、降血糖,提高人體免疫力,延緩衰老、保健美容等功效,沖泡時茶湯清澈明亮,茶香中夾雜靈芝的清香,口感苦后回甘;此外,本發明所述的舞茸靈芝茶,具有靈芝和茶葉清香,湯色紅艷,滋味甘醇,葉底鮮紅明亮,顯著的提升了紅茶的品質和附加值,具有顯著的經濟效率和社會效率,也為保健茶提供更多品種,便于消費者選用。
治療功效:本發明的舞茸靈芝茶具有護肝養胃、安神明目、調節血脂、提高人體免疫力的作用。
本發明還提供了一種檢測增強免疫力的動物試驗方法,采用mtt法檢測cona誘導的小鼠淋巴細胞增殖轉化功能,耳腫脹法檢測小鼠的遲發型變態反應,jerne改良玻片法檢測小鼠抗體生成細胞數,血凝法檢測小鼠血清溶血素水平,半體內法檢測小鼠腹腔巨噬細胞吞噬紅細胞能力,內
附圖說明
圖1是舞茸靈芝茶工藝簡圖;
圖2是灰樹花提取物工藝流程圖;
圖3是靈芝提取物工藝流程圖。
具體實施方式
實施例1:舞茸靈芝茶,以下述重量的原料制成,
紅茶150份、
灰樹花提取物75份、
靈芝提取物25份。
灰樹花提取物的具體制備步驟如下:
b1、將灰樹花原料凈選后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液過200目不銹鋼篩網,合并3次濾液,得b1品;
b2、將b1品真空濃縮至70℃-80℃下的相對密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;
b3、將b2品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得灰樹花提取物。
靈芝提取物的具體制備步驟如下:
c1、將靈芝子實體進行粉碎,得c1品;
c2、將c1品通過水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目篩過濾,合并濾液,得合并濾液c2品;
c3、將c2品減壓濃縮,真空度-0.06~-0.08mpa,濃縮至70℃-80℃下的相對密度1.05-1.15,得濃縮液c3品;
c4、將c3品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得靈芝提取物。
舞茸靈芝茶的具體制備步驟如下:
a、將紅茶采用co60輻照滅菌,輻照劑量6kgy,粉碎過80目篩,得a品;
b、灰樹花提取物過篩,得b品;
c、靈芝提取物過篩,得c品;
d、將a品、b品和c品置于混合機中,混合28~35分鐘,得d品;
e、向d品中加入適量80%乙醇,混合均勻,通過14目篩制粒,再通過65℃烘干,控制水分≤10%,14目篩整粒,得成品;最后將成品顆粒按2.5g/袋進行分裝得舞茸靈芝茶袋,控制裝量差異在±5%,然后裝盒、檢驗、入庫。
實施例2:舞茸靈芝茶,以下述重量的原料制成,
紅茶150份、
灰樹花提取物50份、
靈芝提取物50份。
灰樹花提取物的具體制備步驟如下:
b1、將灰樹花原料凈選后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液過200目不銹鋼篩網,合并3次濾液,得b1品;
b2、將b1品真空濃縮至70℃-80℃下的相對密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;
b3、將b2品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得灰樹花提取物。
靈芝提取物的具體制備步驟如下:
c1、將靈芝子實體進行粉碎,得c1品;
c2、將c1品通過水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目篩過濾,合并濾液,得合并濾液c2品;
c3、將c2品減壓濃縮,真空度-0.06~-0.08mpa,濃縮至70℃-80℃下的相對密度1.05-1.15,得濃縮液c3品;
c4、將c3品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得靈芝提取物。
舞茸靈芝茶的具體制備步驟如下:
a、將紅茶采用co60輻照滅菌,輻照劑量6kgy,粉碎過80目篩,得a品;
b、灰樹花提取物過篩,得b品;
c、靈芝提取物過篩,得c品;
d、將a品、b品和c品置于混合機中,混合28~35分鐘,得d品;
e、向d品中加入適量80%乙醇,混合均勻,通過14目篩制粒,再通過65℃烘干,控制水分≤10%,14目篩整粒,得成品;最后將成品顆粒按2.5g/袋進行分裝得舞茸靈芝茶袋,控制裝量差異在±5%,然后裝盒、檢驗、入庫。
實施例3:舞茸靈芝茶,以下述重量的原料制成,
紅茶150份、
灰樹花提取物25份、
靈芝提取物75份。
灰樹花提取物的具體制備步驟如下:
b1、將灰樹花原料凈選后用水回流提取3次,第1次10倍量提取2h,第2次8倍量提取1.5h,第3次6倍量提取1h,提取液過200目不銹鋼篩網,合并3次濾液,得b1品;
b2、將b1品真空濃縮至70℃-80℃下的相對密度1.10-1.15,真空度-0.06~-0.08mpa,得b2品;
b3、將b2品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得灰樹花提取物。
靈芝提取物的具體制備步驟如下:
c1、將靈芝子實體進行粉碎,得c1品;
c2、將c1品通過水回流提取2次,第一次10倍量2h,第二次8倍量1.5h,提取液200目篩過濾,合并濾液,得合并濾液c2品;
c3、將c2品減壓濃縮,真空度-0.06~-0.08mpa,濃縮至70℃-80℃下的相對密度1.05-1.15,得濃縮液c3品;
c4、將c3品噴霧干燥,入口溫度180±5℃,出口溫度70±5℃,過80目篩,得靈芝提取物。
舞茸靈芝茶的具體制備步驟如下:
a、將紅茶采用co60輻照滅菌,輻照劑量6kgy,粉碎過80目篩,得a品;
b、灰樹花提取物過篩,得b品;
c、靈芝提取物過篩,得c品;
d、將a品、b品和c品置于混合機中,混合28~35分鐘,得d品;
e、向d品中加入適量80%乙醇,混合均勻,通過14目篩制粒,再通過65℃烘干,控制水分≤10%,14目篩整粒,得成品;最后將成品顆粒按2.5g/袋進行分裝得舞茸靈芝茶袋,控制裝量差異在±5%,然后裝盒、檢驗、入庫。
實施例4:增強免疫力動物實驗
用近交系雄性小鼠c57bl/6j,6~8周齡,體重18~22g。根據受試物的人口服推薦量設樣品低、中、高劑量組分別為250、500、1000mg/kgbw,同時設1個陰性對照組,實驗每組15只小鼠。將實施例1中制備的舞茸靈芝茶袋用開水沖泡10分鐘,取出舞茸靈芝茶袋后,分別加水配置成1.25、2.50、5.00mg/ml濃度溶液(按樣品總重量配置),給予相應劑量組動物灌胃,灌胃體積為0.2ml/10gbw,陰性對照組給予等體積的純水,每天灌胃1次,給予時間30天。
1.mtt法cona誘導的小鼠脾淋巴細胞轉化實驗
1.1儀器和材料
rpmi1640細胞培養液、小牛血清、2-巰基乙醇(2-me)、青霉素、鏈霉素、刀豆蛋白a(cona)、鹽酸、異丙醇、mtt、hank's液、pbs緩沖液(ph7.2-7.4)
紗布、200目篩網、24孔培養板,96孔培養板(平底),手術器械、大號注射器內芯、二氧化碳培養箱、酶標儀、分光光度計、超凈工作臺、高壓滅菌器、無菌濾器。
1.2實驗步驟
1.2.1試劑配制
完全培養液rpmi1640培養液過濾除菌,用前加入10%小牛血清,1%谷氨酰胺(200mmol/l),青霉素(100u/ml),鏈霉素(100ug/l)及5×10-5mol/l的2-巰基乙醇,用無菌的1mol/l的hcl或1mol/l的naoh調ph至7.0-7.2,即完全培養液。
cona液用雙蒸水配制成100ug/ml的溶液,過濾除菌,在低溫冰箱(-20℃)保存。
無菌hank's液用前以3.5%的無菌nahco3調ph7.2-7.4。
mtt液將5mgmtt溶于1mlph7.2的pbs中,現配現用。
酸性異丙醇溶液96ml異丙醇中加入4ml1mol/l的hcl,臨用前配制。
1.2.2脾細胞懸液制備
無菌取脾,置于盛有適量(3-5ml)無菌hank's液平皿中,并在脾上面放置一塊紗布,用大號注射器內芯輕輕將脾磨碎,制成單個細胞懸液。經200目篩網過濾,用hank's液洗2次,每次離心10min(1000r/min)。然后將細胞懸浮于2ml的完全培養液中,用全自動細胞計數儀計數脾細胞,或用臺酚蘭染色計數活細胞數(應在95%以上),調整細胞濃度為3×106個/ml。
1.2.3淋巴細胞增殖反應
將細胞懸液分兩孔加入24孔培養板中,每孔1ml,一孔加75μlcona液(相當于7.5μg/ml),另一孔作為對照,置5%co2,37℃co2孵箱中培養72h。培養結束前4h,每孔輕輕吸去上清液0.7ml,加入0.7ml不含小牛血清的rpmi1640培養液,同時加入mtt(5mg/ml)50μl/孔,繼續培養4h。培養結束后,每孔加入1ml酸性異丙醇,超聲震蕩(2秒)或人工吹打混勻,使紫色結晶完全溶解。然后分裝到96孔培養板中,每個孔分裝3孔作為平行樣,用酶聯免疫檢測儀,以570nm波長測定光密度值。也可將溶解液直接移入2ml比色杯中,分光光度計上在波長570nm測定od值。
1.3數據處理及結果
cona誘導的小鼠淋巴細胞轉化試驗結果(見表1)表明,樣品3個劑量組小鼠的淋巴細胞轉化能力均高于陰性對照組(f=3.514,p=0.025),其中高劑量組與陰性對照組比較差異有統計學意義。
表1小鼠免疫功能相關試驗結果
2二硝基氟苯誘導小鼠遲發型變態反應(耳腫脹法)
2.1材料
dnfb、丙酮、麻油、硫化鋇、打孔器。
2.2實驗步驟
2.2.1試劑配制
dnfb溶液dnfb溶液應新鮮配制,稱取dnfb50mg,置清潔干燥小瓶中,將預先配好的5ml丙酮麻油溶液(丙酮:麻油=1:1),倒入小瓶,蓋好瓶塞并用膠布密封。混勻后,用250μl注射器通過瓶蓋取用。
2.2.2致敏
每鼠腹部皮膚用硫化鋇脫毛,范圍約3cm×3cm、用dnfb溶液50μl均勻涂抹致敏。
2.2.3遲發型變態反應(dth)的產生與測定
5天后,用dnfb溶液10μl均勻涂抹于小鼠右耳(兩面)進行攻擊。攻擊后24h頸椎脫臼處死小鼠,剪下左右耳殼。用打孔器取下直徑8mm的耳片,稱重。
2.2.4數據處理與結果
遲發型變態反應試驗結果如表1所示,表明樣品三個劑量組小鼠的左右耳片重量差值均高于陰性對照組,其中高劑量組與陰性對照組相比差異有統計學意義。
從cona誘導的小鼠淋巴細胞轉化試驗和遲發型變態反應試驗結果,可以判定細胞免疫試驗結果陽性。
3.抗體生成細胞檢測
3.1儀器和材料
溶血空斑自動圖象分析儀、二氧化碳培養箱、恒溫水浴、離心機、手術器械、200目篩網、srbc、補體(豚鼠血清)、hank's液、rpmi1640培養液、sa緩沖液(c4h4n2o30.46g,mgcl20.1g,cacl2.2h2o0.2g,nacl8.38g,nahco30.252gandc8h11n2nao30.3g,加蒸餾水至1000ml)、滅菌生理鹽水、瓊脂糖。
3.2實驗步驟:
3.2.1srbc
綿羊頸靜脈取血,將羊血放入有玻璃珠的滅菌錐形瓶中,朝一個方向搖動,以脫纖維,生理鹽水2500rpm/min,15min,洗滌3次,制備壓積srbc,放入4℃冰箱保存備用。
3.2.2完全培養基的制備:新生小牛血清經綿羊紅細胞(v/v,5:1)吸收,4℃,30-60min后,加入不完全培養基rpmi1640中,制備成含20%小牛血清的完全培養基。
3.2.3補體制備
股動脈取血,靜置30-60min,2500rpm/min,15min分離血清,將5-10只豚鼠血清混合后,與壓積srbc以5:1(v/v)比例混合,4℃冰箱放置30-60min,間或震蕩,2500rpm/min,15min分離血清,分裝,-80℃冰箱保存。用時以完全培養基1:10(v/v)比例稀釋。
3.2.4免疫動物
壓積srbc以生理鹽水制成2%(v/v)的細胞懸液(約1×108個srbc),每只鼠腹腔注射0.2ml。
3.2.5脾細胞懸液制備
將srbc免疫4-5天后的小鼠頸椎脫臼處死,無菌取脾臟,并在脾上面放置一塊紗布,用大號注射器內芯輕輕將脾磨碎,制成單個細胞懸液,200目篩網過濾,1000rpm/min,10min,去上清,hank’液洗2遍,以完全培養基rpmi1640制備成5×106~1×107個細胞/ml的脾細胞懸液。
3.2.6空斑的測定
3.2.6.1底層培養基制備0.5g瓊脂糖加入100ml滅菌生理鹽水中,加熱溶解,待溫度于50℃左右時,以1ml/孔的量加至六孔培養板中,瓊脂凝固后備用。
3.2.6.2頂層培養基制備0.5g瓊脂糖加入100mlhank’s液中(ph7.2-7.4),加熱溶解,以0.5ml/試管的量加至46-50℃恒溫的試管中。
3.2.6.3鋪板50μl20%srbc(生理鹽水配制,v/v)、200μl脾細胞懸液先后加入含有0.5ml頂層的試管中,迅速混勻,倒入六孔板中并鋪平頂層混合液,每個樣本做兩個平行孔。
3.2.6.4空斑測定:已制備好培養板放入37℃、5%co2培養箱中孵育1h,然后每孔加入500μl以完全培養基稀釋的補體(v/v,1:10),繼續孵育2h,自動圖象分析儀讀取溶血空斑圖象分析軟件計數溶血空斑數。取平行孔空斑數的平均值為樣本的溶血空斑數值,以空斑數/106脾細胞表示。
3.3數據處理及結果
抗體生成細胞測定結果如表1所示,其結果表明樣品各劑量組小鼠的抗體生成細胞數均高于陰性對照組。
4.血清溶血素的測定(血凝法)
4.1儀器和材料
srbc、生理鹽水、微量血凝實驗板、離心機
4.2實驗步驟
4.2.1srbc綿羊頸靜脈取血,將羊血放入有玻璃珠的滅菌錐形瓶中,朝一個方向搖動,以脫纖維,放入4℃冰箱保存備用,可保存2周。
4.2.2免疫動物及血清分離取羊血,用生理鹽水洗滌3次,每次離心(2000r/min)10min。將壓積srbc用生理鹽水配成2%(v/v)的細胞懸液,每只鼠腹腔注射0.2ml進行免疫。4~5d后,摘除眼球取血于離心管內,放置約1h,將凝固血與管壁剝離,使血清充分析出,2000r/min離心10min,收集血清。
4.2.3凝集反應用生理鹽水將血清倍比稀釋,將不同稀釋度的血清分別置于微量血凝實驗板內,每孔100μl,再加入100μl0.5%(v/v)的srbc懸液,混勻,裝入濕潤的平盤內加蓋,于37℃溫箱孵育3h,觀察血球凝集程度。
4.3數據處理及結果
血清溶血素測定結果(如表1所示),表明樣品各劑量小鼠的抗體積數均高于陰性對照組。
5.小鼠碳廓清實驗
5.1儀器和試劑
分光光度計、全自動酶標儀、計時器、血色素吸管、印度墨汁、na2co3
5.2實驗步驟
5.2.1溶液配制
注射用墨汁將印度墨汁原液用生理鹽水稀釋3~4倍。
na2co3溶液取0.1gna2co3,加蒸餾水至100ml。
5.2.2注射墨汁稱體重,從小鼠尾靜脈注入稀釋的印度墨汁,按每10g體重0.1ml計算。待墨汁注入,立即計時。
5.2.3測定
注入墨汁2分鐘和10分鐘后,分別從內眥靜脈叢取血20μl,并立即將其加到2ml0.1%na2co3溶液中。用分光光度計或全自動酶標儀在600nm波長處測光密度值(od),以na2co3溶液作空白對照。
將小鼠處死,取肝臟和脾臟,用濾紙吸干臟器表面血污,稱重。
以吞噬指數表示小鼠碳廓清的能力。按下式計算吞噬指數a:
k=(lgod1-lgod2)/(t2-t1)
吞噬指數a=體重/(肝重+脾重)×
5.2.4數據處理及結果
小鼠碳廓清實驗結果如表2所示,其結果表明樣品各劑量組小鼠的小鼠碳廓清能力均高于陰性對照組。
表2小鼠免疫功能相關試驗結果
6.小鼠腹腔巨噬細胞吞噬熒光微球試驗方法
6.1儀器和材料
hank's液,小牛血清,pbs緩沖液,生理鹽水,熒光微球(φ2μm),1%小牛血清白蛋白(bsa)。
流式細胞儀,超聲清洗儀,二氧化碳細胞培養箱,離心機,6孔培養板,細胞刮,過濾器(75m),流式上樣管,流式細胞儀專用鞘液,移液槍及吸頭,白細胞計數板,手術器械一套,注射器,滴管,膠頭吸管。
6.2實驗步驟
6.2.1試劑配制
6.2.1.1含5%小牛血清的hank's液:取10ml小牛血清加入200mlhank's液中,混勻,臨用前配。
6.2.1.2pbs緩沖液的配制方法:kh2po46.66g,na2hpo4·12h2o6.38g,將上述試劑溶于1000ml蒸餾水中調ph值至7.2即成。
6.2.1.32%綿羊紅細胞懸液的配制方法:實驗前取綿羊頸靜脈血,置于盛有玻璃珠(20個左右)的三角瓶內,連續順一個方向充分搖動5~10分鐘,除去纖維蛋白,用生理鹽水洗滌3次,每次1500rpm,離心10分鐘,4℃冰箱保存。實驗前棄去上清,按血球壓積用生理鹽水配制成2%的紅細胞懸液。
6.2.1.41%bsa的配制:0.5gbsa溶于50mlpbs緩沖液中,臨用前配較好。
6.2.1.5熒光微球預調理:100μl熒光微球與10ml1%bsa37℃避光孵育30min,超聲處理5min,臨用前配。
6.2.2腹腔巨噬細胞吞噬熒光微球過程
實驗前4天給每只小鼠腹腔注射0.2ml2%綿羊血紅細胞激活小鼠巨噬細胞,實驗當天用頸椎脫臼法處死小鼠,腹腔注射加小牛血清的hank's液3ml/只,輕輕按揉腹部20次,以充分洗出腹腔巨噬細胞,然后將腹壁剪開一個小口,吸取腹腔洗液2ml用75μm過濾器過濾至試管內,調整巨噬細胞數為4~6×105/ml。用移液槍吸取1ml腹腔洗液于6孔培養板中,加入已經預調理過的熒光微球(1×107/板),37℃二氧化碳細胞培養箱(或室溫)避光孵育90~120分鐘,孵育結束后棄上清(含未貼壁細胞和多余熒光微球),每次使用1.0mlpbs緩沖液輕輕洗滌2次,去上清后再加入4℃pbs緩沖液0.3ml,用細胞刮刮下貼壁細胞,輕輕吹打均勻后經75μm過濾器過濾后上機分析。
6.2.3流式細胞儀檢測分析
6.2.3.1設門:首先設立fsc-ssc二維散點圖,通過調節fsc和ssc電壓值,以巨噬細胞設門界定分析的巨噬細胞群,最大限度地排除其它有核細胞、細胞碎片等的干擾;
6.2.3.2獲取:在熒光微球發射光的熒光通路檢測巨噬細胞的熒光強度,每份樣本獲取5000個巨噬細胞,數據可顯示于二維散點圖和直方圖中。在二維散點圖中可通過設門圈定未吞噬熒光微球的巨噬細胞群和吞噬熒光微球的巨噬細胞群;在直方圖中可通過標尺標定未吞噬熒光微球的巨噬細胞群和吞噬熒光微球的巨噬細胞群,全部數據經相關軟件分析未吞噬熒光微球的巨噬細胞和吞噬不同數量熒光微球的巨噬細胞的比例。
6.3數據處理及結果
吞噬百分率(%)=吞噬熒光微球的巨噬細胞數/計數的巨噬細胞數×100
吞噬指數=被吞噬的熒光微球總數/計數的巨噬細胞數
以吞噬百分率或吞噬指數表示小鼠巨噬細胞的吞噬能力。吞噬百分率需進行數據轉換,x=sin-1
其結果如表2所示,結果表明樣品各劑量組小鼠的腹腔巨噬細胞的吞噬指數及吞噬率均高于陰性對照組。
7.nk細胞活性測定(乳酸脫氫酶測定法)
7.1儀器和材料
酶標儀、全自動細胞計數儀、yac-1細胞、hank's液(ph7.2~7.4)、rpmi1640完全培養液、乳酸鋰或乳酸鈉、硝基氯化四氮唑(int)、吩嗪二甲酯硫酸鹽(pms)、nad、0.2mol/l的tris-hcl緩沖液(ph8.2)、1%np40或2.5%triton
7.2實驗步驟
7.2.1ldh基質液的配制
乳酸鋰5×10-2mol/l
硝基氯化四氮唑(int)6.6×10-4mol/l
吩嗪二甲酯硫酸鹽(pms)2.8×10-4mol/l
氧化型輔酶ⅰ(nad)1.3×10-3mol/l
將上述試劑溶于0.2mol/l的tris-hcl緩沖液中(ph8.2)
7.2.2靶細胞的傳代(yac-1細胞)
實驗前24h將靶細胞進行傳代培養。應用前以hank's液洗3次,用rpmi1640完全培養液調整細胞濃度為4×105個/ml。
7.2.3脾細胞懸液的制備(效應細胞)
無菌取脾,置于盛有適量無菌hank's液的小平皿中,并在脾上面放置一塊紗布,用大號注射器內芯輕輕將脾磨碎,制成單個細胞懸液。經200目篩網過濾,用hank's液洗2次,每次離心10min(1000r/min)。棄上清將細胞漿彈起,加入0.5ml滅菌水20秒,裂解紅細胞后再加入0.5ml2倍hank’s液及8mlhank’s液,1000rpm,10min離心,然后將細胞懸浮于2ml的完全培養液中,用全自動細胞計數儀計數脾細胞;或用1ml含10%小牛血清的rpmi1640完全培養液重懸,用1%冰醋酸稀釋后計數(活細胞數應在95%以上),用臺酚蘭染色計數活細胞數(應在95%以上),最后用rpmi1640完全培養液調整細胞濃度為2×107個/ml。
7.3nk細胞活性檢測
取靶細胞和效應細胞各100μl(效靶比50:1),加入u型96孔培養板中;靶細胞自然釋放孔加靶細胞和培養液各100μl,靶細胞最大釋放孔加靶細胞和1%np40或2.5%triton各100μl;上述各項均設三個復孔,于37℃、5%co2培養箱中培養4h,然后將96孔培養板以1500r/min離心5min,每孔吸取上清100μl置平底96孔培養板中,同時加入ldh基質液100μl,反應3min,每孔加入1mol/l的hcl30μl,在酶標儀490nm處測定光密度值(od)。
按下式計算nk細胞活性:
nk細胞活性%=(反應孔od-自然釋放孔od)/(最大釋放孔od-自然釋放孔od)×100%
7.4數據處理及結果
nk細胞活性需進行數據轉換,x=sin-1
其結果如表2所示,結果表明樣品各劑量組小鼠的nk細胞活性均高于陰性對照組。
8.結論
通過cona誘導的小鼠淋巴細胞增殖轉化功能檢測,遲發型變態反應檢測,小鼠抗體生成細胞數檢測,小鼠血清溶血素水平檢測,小鼠腹腔巨噬細胞吞噬紅細胞能力檢測,碳廓清能力檢測,nk細胞活性測定,結果表明本發明所述的組合物具有增強免疫力的功能。
- 還沒有人留言評論。精彩留言會獲得點贊!