一種利用花藥培養獲得馬鈴薯雙單倍體植株的方法及其培養基與流程
本發明屬于植物細胞工程技術領域,具體涉及一種利用花藥培養獲得馬鈴薯雙單倍體植株的方法及其培養基。
背景技術:
馬鈴薯(solanumtuberosuml.)為茄科茄屬植物,是重要的糧食和蔬菜兼用作物。目前,我國馬鈴薯的生產與消費均居于世界前列,其種植面積約600萬公頃,總產量達1億噸。寧夏南部山區是我國重要的馬鈴薯優勢產區,氣候特點及土壤條件十分適合馬鈴薯的生長和干物質的積累,生產出的馬鈴薯淀粉含量高、品質好。至2015年,馬鈴薯已成為寧夏第一大種植作物,種植面積超過24萬公頃,在當地農業產業結構調整、保障糧食安全及農村經濟發展中發揮著重要作用。
馬鈴薯種植區多分布在土壤貧瘠的南部山區和中部干旱區,水資源缺乏、干旱、冷害等非生物脅迫頻發,加之生產中使用的品種單一,對馬鈴薯的產量及質量常常造成嚴重損失,極大地影響了我區馬鈴薯產業均衡、可持續發展。隨著當前馬鈴薯主糧化戰略的推進,在與其他三大主糧不爭地的前提條件下,生產上亟需選育具有優良農藝性狀、抗逆性強的馬鈴薯品種,進一步提高馬鈴薯單產水平,是滿足馬鈴薯產業的發展和保障糧食安全的必然要求。由于馬鈴薯屬于同源四倍體植物,遺傳背景狹窄,采用常規育種手段創制馬鈴薯新種質的困難越來越大,迫切需要通過生物技術手段促進品種選育。花藥培養技術是迄今為止創造純和基因型最有效手段,在育種工作中,利用這項技術除可以大大縮短種質材料的純化時間,對雜交f1、f2代的花藥培養可選擇出特異的性狀外,還可通過花藥培養方法建立dh群體,直接獲得純化品系,作為育種中間材料或親本育種新品種。
將生物技術育種結合于常規育種中,已成為當代作物遺傳育種的重要特點。應用花藥培養降低作物倍性獲得的單倍體植株,無論是在作物的育種,還是在遺傳圖譜構建、重要性狀qtl定位及基因的克隆篩選等分子生物學研究都具有重要應用價值。雖然我國馬鈴薯花藥培養盡管在上世紀80年代初就已經開展,但仍存在著基因型限制、成胚率低等需要克服的問題,限制了單倍體育種技術在育種實踐中的應用。
技術實現要素:
有鑒于此,本發明的目的在于提供一種利用花藥培養獲得馬鈴薯雙單倍體植株的方法及其培養基,所述方法受基因型的限制小,具有較高的分化率。
為了實現上述發明目的,本發明提供以下技術方案:
本發明提供了一種利用花藥培養獲得馬鈴薯雙單倍體植株的分化培養基,以ms培養基為基礎培養基,包括以下組分:質量濃度為0.4~0.6mg/l赤霉素、質量濃度為1.5~3.0mg/l的6-芐氨基嘌呤、質量濃度為2.5~3.5mg/l玉米素、質量濃度為3.0%的蔗糖和質量濃度為0.4%~0.6%的瓊脂;所述ms培養基包括以下組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。
優選的,所述赤霉素在ms培養基中的質量濃度為0.5mg/l。
優選的,所述6-芐氨基嘌呤在ms培養基中的質量濃度為2.0mg/l。
優選的,所述玉米素在ms培養基中的質量濃度為3.0mg/l。
本發明還提供了一種利用花藥培養獲得馬鈴薯雙單倍體植株的方法,包括以下步驟:
1)在馬鈴薯現蕾期至初花期的花蕾放入4~6℃環境中預處理48~72h;
2)將所述步驟1)中預處理后的花蕾進行滅菌后,挑取花蕾中的花藥接種于誘導培養基中,在30~35℃條件下高溫處理48~72h,再在22~26℃條件下誘導培養40~50d,光照條件為黑暗24h,獲得花藥愈傷組織;
3)將所述步驟2)誘導獲得的花藥愈傷組織,轉入所述分化培養基中進行分化培養d,挑取分化出綠色芽點的愈傷組織轉入分化培養基中進行繼代培養30~50d,獲得馬鈴薯小苗;
4)將所述步驟3)中繼代分化出的馬鈴薯小苗轉入生根培養基中生根培養,獲得馬鈴薯花藥培養完整植株。
優選的,所述步驟1)中花蕾長度為4~6mm;花蕾的采集時間為上午9:00~10:00;花蕾的形態為花瓣與花萼等長。
優選的,所述步驟2)中花藥的長度為2~3mm,花藥的顏色為綠色。
優選的,所述步驟2)中誘導培養基為以ms培養基為基礎培養基,包含附加物和植物激素;
所述附加物為下列質量含量的組分:硝酸銀30~50mg/l,活性炭1.5~3g/l,蔗糖6%,瓊脂0.4~0.6%;
所述植物激素包括以下重量含量組分:1mg/l2,4-二氯苯氧乙酸,0.5mg/l萘乙酸,1mg/l激動素。
優選的,所述步驟3)中分化培養和繼代培養的光照條件為光照16h/黑暗8h,培養溫度為22~26℃。
優選的,所述步驟4)中生根培養基為以ms培養基為基礎培養基,包含質量濃度為0.050.1mg/l的萘乙酸、質量濃度為1.5%的蔗糖和質量濃度為0.4~0.6%瓊脂;所述步驟4)中培養時間為30~40d。
本發明提供了一種利用花藥培養獲得馬鈴薯雙單倍體植株的分化培養基,以ms培養基為基礎培養基,包括以下組分:質量濃度為0.4~0.6mg/l赤霉素、質量濃度為1.5~3.0mg/l的6-芐氨基嘌呤、質量濃度為2.5~3.5mg/l玉米素、質量濃度為3.0%的蔗糖和質量濃度為0.4%~0.6%的瓊脂。所述培養基通過將赤霉素、6-芐氨基嘌呤和玉米素添加到ms培養基中,大大提高了馬鈴薯花藥培養的培養效率,分化率達到6.1~16.9%,較其他常規分化培養基提高了60~120%。
本發明提供的一種利用花藥培養獲得馬鈴薯雙單倍體植株的方法,通過嚴格限定花藥取材時期及花藥低溫和高溫處理,經花藥愈傷組織誘導培養基誘導以及分化培養基分化,獲得花藥培養植株。與其他馬鈴薯花藥培養方法相比,受基因型限制更小,花藥培養植株更易獲得,實施例中采用所述方法對7個馬鈴薯四倍體栽培種(系)花藥培養的研究試驗表明,7個品種的花藥愈傷組織誘導率達到8.0~31.7%,其中5個品種(系)可成功分化誘導出花藥植株。通過倍性分析儀的鑒定,篩選獲得了雙單倍體植株。因此,所述方法為馬鈴薯倍性育種研究提供重要的理論與實踐。
附圖說明
圖1為實施例4中馬鈴薯接種花藥與對應的減數分裂時期;
圖2為實施例4中馬鈴薯花藥誘導出的愈傷組織;
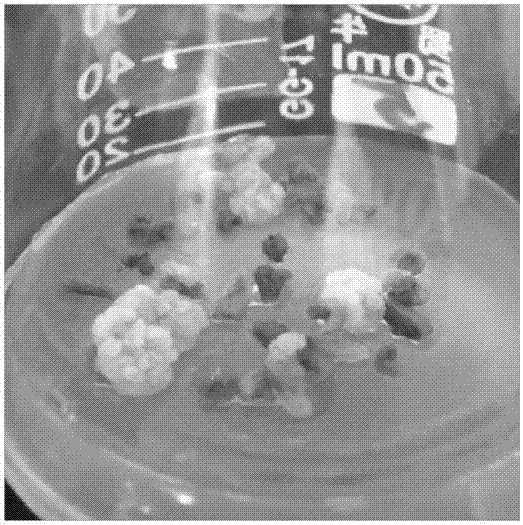
圖3為實施例4中馬鈴薯花藥愈傷組織分化出苗;
圖4為實施例4中馬鈴薯花藥培養植株的倍性鑒定;
圖5為實施例4中馬鈴薯栽培種及其花藥培養雙單倍植株形態比較。
具體實施方式
本發明提供了一種利用花藥培養獲得馬鈴薯雙單倍體植株的分化培養基,以ms培養基為基礎培養基,包括以下組分:質量濃度為0.4~0.6mg/l赤霉素、質量濃度為1.5~3.0mg/l的6-芐氨基嘌呤、質量濃度為2.5~3.5mg/l玉米素、質量濃度為3.0%的蔗糖和質量濃度為0.4%~0.6%的瓊脂;所述ms培養基包括以下組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。
本發明中,所述赤霉素在ms培養基中的質量濃度優選為0.5mg/l。本發明對赤霉素的來源沒有特殊限制,采用本領域技術人員所熟知的赤霉素的來源即可。本發明實施例中,所述赤霉素購自北京酷萊博生物技術有限公司。
本發明中,所述6-芐氨基嘌呤在ms培養基中的質量濃度優選為2mg/l。本發明對6-芐氨基嘌呤的來源沒有特殊限制,采用本領域技術人員所熟知的6-芐氨基嘌呤的來源即可。本發明實施例中,所述6-芐氨基嘌呤購自北京酷萊博生物技術有限公司。
本發明中,所述玉米素在ms培養基中的質量濃度優選為3mg/l。本發明對玉米素的來源沒有特殊限制,采用本領域技術人員所熟知的玉米素的來源即可。本發明實施例中,所述玉米素購自北京酷萊博生物技術有限公司。
本發明中,所述蔗糖在ms培養基中的質量濃度優選為3%。本發明對蔗糖的來源沒有特殊限制,采用本領域技術人員所熟知的蔗糖的來源即可。本發明實施例中,所述蔗糖購自國藥集團化學試劑有限公司。
本發明中,所述瓊脂在ms培養基中的質量濃度優選為0.5%。本發明對瓊脂的來源沒有特殊限制,采用本領域技術人員所熟知的瓊脂的來源即可。本發明實施例中,所述瓊脂購自北京酷萊博生物技術有限公司。
本發明中,所述ms培養基包括以下組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。所述ms培養基的原料的來源沒有特殊限制,采用本領域技術人員所熟知的來源即可。所述ms培養基的制備方法優選參照murashige&skoog(1962)的方法配制。
本發明中,所述分化培養基的ph值優選為5.6~6.0,更優選為5.8。
本發明中,所述分化培養基的配制方法包括以下步驟:
a.向上述配制得到的ms培養基中添加蔗糖與瓊脂,再添加赤霉素、6-芐氨基嘌呤和玉米素,最后以1mol/lhcl或1mol/lnacl調節培養基ph值。
分化培養基的滅菌方法采用高壓蒸汽滅菌、滅菌壓力為1.2kg/cm2,溫度為121℃,滅菌時間為15~20min。
本發明還提供了一種利用花藥培養獲得馬鈴薯雙單倍體植株的方法,包括以下步驟:
1)摘取現蕾期至初花期的花蕾放入4~6℃環境中預處理48~72h;
2)將所述步驟1)中預處理后的花蕾進行滅菌后,挑取花蕾中的花藥接種于誘導培養基中,在30~35℃條件下高溫處理48~72h,再在22~26℃條件下誘導培養40~50d,獲得花藥愈傷組織;
3)將所述步驟2)誘導獲得的花藥愈傷組織,轉入上述方案得到的分化培養基中進行分化培養60~80d,挑取分化出綠色芽點的愈傷組織轉入分化培養基中進行繼代培養30~50d,獲得馬鈴薯小苗;
4)將所述步驟3)中繼代分化出的馬鈴薯小苗轉入生根培養基中生根培養,獲得馬鈴薯花藥培養完整植株。
本發明將摘取現蕾期至初花期的花蕾放入4~6℃環境中預處理48~72h。
本發明中,所述花蕾長度優選為4~6mm,更優選為5mm。花蕾的采集時間優選為上午9:00~10:00,有利于保持花藥活力。花蕾的形態優選為花瓣與花萼等長。
本發明中,所述花蕾優選放入5℃環境中。預處理的時間優選為55~65h,更優選為60h。本發明中,所述花蕾低溫處理的目的是促進雄核發育以提高花粉植株誘導頻率。
得到預處理后的花蕾后,本發明將所述花蕾進行滅菌后,挑取花蕾中的花藥接種于誘導培養基中,在30~35℃條件下高溫處理48~72h,再在22~26℃條件下誘導培養40~50d,光照條件為黑暗24h,獲得花藥愈傷組織。
本發明中,所述滅菌的方法優選為先將花蕾置于75%酒精溶液中表面滅菌30s,無菌水沖洗1次,隨后置于0.1%升汞溶液中表面消毒8min,無菌水沖洗3~4次,每次2~3min。
本發明中,所述挑取花藥的方法優選將滅菌后的花蕾放置在無菌試紙上,用鑷子夾住花蕾的基部,接種針劃開花蕾表面挑取花藥隨即接種于誘導培養基中。
本發明中,所述接種的方法沒有特殊限制,采用本領域技術人員所熟知的接種方法即可。所述接種量優選為盛有培養基的50ml三角瓶中每瓶接種花藥10~15枚。
本發明中,所述花藥的長度優選為2~3mm,花藥的顏色優選為綠色。
本發明中,所述誘導培養基優選以ms培養基為基礎培養基,包含附加物和植物激素;
所述附加物優選包括下列質量含量的組分:硝酸銀30mg/l,活性炭3g/l,蔗糖6%和瓊脂0.6%;
所述植物激素優選包括以下重量含量組分:1mg/l2,4-二氯苯氧乙酸,0.5mg/l萘乙酸和1mg/l激動素。
所述誘導培養基的配制方法沒有特殊限制,采用本領域技術人員所熟知的配制方法即可。
本發明中,所述高溫處理的溫度優選為34℃。所述高溫處理的時間優選為48~72h。所述誘導培養的溫度優選為25℃。所述誘導培養的時間優選為45h。所述高溫處理和誘導培養優選進行黑暗條件下培養。
得到的花藥愈傷組織后,本發明將所述花藥愈傷組織轉入所述分化培養基中進行分化培養60~80d,挑取分化出綠色芽點的愈傷組織轉入分化培養基中進行繼代培養28~35d,得到馬鈴薯小苗。
本發明中,所述分化培養的時間優選為70h。所述繼代培養的時間優選為32h。
本發明中,所述分化培養和繼代培養的光照條件優選為光照16h/黑暗8h。培養溫度為22~26℃,更優選為25℃。
本發明中,花藥誘導出的愈傷組織形成于花藥裂縫處,外形致密,顏色多為白色或淡黃色,生長緩慢。
得到繼代分化出的馬鈴薯小苗,本發明將所述繼代分化出的馬鈴薯小苗轉入生根培養基中生根培養,得到馬鈴薯雙單倍體植株。
本發明中,所述生根培養基優選以ms培養基為基礎培養基,包含質量濃度為0.05~0.1mg/l的萘乙酸、質量濃度為1.5%的蔗糖和質量濃度為0.4%~0.6%瓊脂;更優選為包含質量濃度為0.08mg/l的萘乙酸和質量濃度為0.5%瓊脂。
本發明中,所述生根培養時間優選為30~40d,更優選為35d。
本發明中,所述生根培養的光照條件優選為光照16h/黑暗8h。培養溫度為22~26℃,更優選為25℃。
本發明中,所述方法還優選包括馬鈴薯雙單倍體材料的鑒定。所述鑒定方法如下:以馬鈴薯四倍體栽培品種和花藥培養植株的葉片為材料,分別提取細胞核懸液并染色,利用染色體倍性分析儀對測試樣品進行檢測。以馬鈴薯四倍體栽培種細胞核dna峰值的位置為對照,根據已知倍性的峰值位置,所有測試樣品細胞核dna含量是以對照為標準的相對值,即可判斷未知樣品的倍性。本實驗利用這一技術對馬鈴薯花藥培養植株倍性水平進行了鑒定,從中獲得了馬鈴薯雙單倍體材料。
下面結合實施例對本發明提供的一種利用花藥培養獲得馬鈴薯雙單倍體植株的方法及其培養基進行詳細的說明,但是不能把它們理解為對本發明保護范圍的限定。
實施例1
所述ms培養基包括以質量濃度組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。將上述組分混合后得到ms培養基,添加蔗糖使其質量濃度達到為3.0%,稱量瓊脂使其質量濃度為0.5%,充分攪拌后,將赤霉素溶于ms培養基中,使其質量濃度為0.4mg/l,添加6-芐氨基嘌呤到ms培養基中使其質量濃度為3.0mg/l,將玉米素添加到ms培養基中,使其質量濃度為2.5mg/l,調節ph值至5.8,滅菌后得到分化培養基。
實施例2
所述ms培養基包括以質量濃度組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。將上述組分混合后得到ms培養基,添加蔗糖使其質量濃度達到為3.0%,稱量瓊脂使其質量濃度為0.6%,充分攪拌后,將赤霉素溶于ms培養基中,使其質量濃度為0.6mg/l,添加6-芐氨基嘌呤到ms培養基中使其質量濃度為1.5mg/l,將玉米素添加到ms培養基中,使其質量濃度為3.5mg/l,調節ph值至5.8,滅菌后得到分化培養基。
實施例3
所述ms培養基包括以質量濃度組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。將上述組分混合后得到ms培養基,添加蔗糖使其質量濃度達到為3%,稱量瓊脂使其質量濃度為0.5%,充分攪拌后,將赤霉素溶于ms培養基中,使其質量濃度為0.5mg/l,添加6-芐氨基嘌呤到ms培養基中使其質量濃度為2mg/l,將玉米素添加到ms培養基中,使其質量濃度為3.0mg/l,調節ph值至5.8,滅菌后得到分化培養基。
對比例1
所述ms培養基包括以質量濃度組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。將上述組分混合后得到ms培養基,添加蔗糖使其質量濃度達到為3%,稱量瓊脂使其質量濃度為0.6%,充分攪拌后,將赤霉素溶于ms培養基中,使其質量濃度為0.2mg/l,添加6-芐氨基嘌呤到ms培養基中使其質量濃度為1mg/l,將3-吲哚丁酸添加到ms培養基中,使其質量濃度為0.5mg/l,調節ph值至5.8,滅菌后得到分化培養基。
對比例2
所述ms培養基包括以質量濃度組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。將上述組分混合后得到ms培養基,添加蔗糖使其質量濃度達到為3%,稱量瓊脂使其質量濃度為0.6%,充分攪拌后,將赤霉素溶于ms培養基中,使其質量濃度為0.2mg/l,將3-吲哚乙酸添加到ms培養基中,使其質量濃度為0.5mg/l,調節ph值至5.8,滅菌后得到分化培養基。
對比例3
所述ms培養基包括以質量濃度組分:硝酸銨1650mg/l、硝酸鉀1900mg/l、氯化鈣440mg/l、硫酸鎂370mg/l、磷酸二氫鉀170mg/l,碘化鉀0.83mg/l,硼酸6.2mg/l,硫酸錳22.3mg/l,硫酸鋅8.6mg/l,鉬酸鈉0.25mg/l,硫酸銅0.025mg/l,氯化鈷0.025mg/l,乙二胺四乙酸二鈉37.3mg/l,硫酸亞鐵27.8mg/l,肌醇100mg/l,甘氨酸2mg/l,鹽酸硫胺素0.1mg/l,鹽酸吡哆醇0.5mg/l,煙酸0.5mg/l。將上述組分混合后得到ms培養基,添加蔗糖使其質量濃度達到為3%,稱量瓊脂使其質量濃度為0.6%,充分攪拌后,將赤霉素溶于ms培養基中,使其質量濃度為0.2mg/l,添加6-芐氨基嘌呤到ms培養基中使其質量濃度為6mg/l,將玉米素添加到ms培養基中,使其質量濃度為2.0mg/l,調節ph值至5.8,滅菌后得到分化培養基。
實施例4
將實施例1~3與對比例1~3制備的分化培養基用于組織培養中
(1)選擇現蕾至初花期取長度為5mm的花蕾,放置4℃冰箱預處理3d。將處理好的材料在超凈工作臺無菌環境下,將花蕾先置于75%酒精溶液中表面滅菌30s,無菌水沖洗1次,隨后轉入0.1%升汞溶液中滅菌8min,再用無菌水沖洗3次,每次2min。滅菌后置于無菌濾紙上,用鑷子與接種針將花藥從花蕾中剝離出,接種于盛有誘導培養基的50ml三角瓶中,每瓶放10枚花藥,封口膜封口。
(2)誘導培養基由ms培養基、附加物、植物激素三部分成分組成。ms培養基參照murashige&skoog(1962)的方法配制,附加物為硝酸銀30mg/l,活性炭3g/l,蔗糖6%(w/v),瓊脂0.6%(w/v);添加的植物激素組合為:1mg/l2,4-二氯苯氧乙酸(2,4-d),0.5mg/l萘乙酸(naa),1mg/l激動素(kt)。采用高壓滅菌,滅菌壓力為1.2kg/cm2,溫度為121℃,滅菌時間為15min。
(3)將接種后的花藥置于35℃恒溫培養箱中黑暗培養72h,隨后轉入24℃、黑暗條件下誘導培養45d后,挑取花藥裂縫處形成白色或淡黃色愈傷組織轉入分化培養基中分化培養60-80d,光照條件為光照16h/黑暗8h,培養溫度為24℃;選擇分化出綠色芽點的愈傷組織轉入分化培養中繼代培養30d,光照條件為光照16h/黑暗8h,培養溫度為24℃;分化培養基及繼代培養基為實施例1~3與對比例1~3制備的分化培養基。
(4)待繼代分化出的小苗長至2-3片小葉時,轉入生根培養基中生根培養30d,光照條件為光照16h/黑暗8h,培養溫度為24℃。當花藥培養植株葉片長至7~8片,根長為4~5cm時,經倍性鑒定后即可煉苗及移栽。
分化率=分化出綠芽的愈傷組織數/花藥誘導出的愈傷組織數×100%;出苗率=綠苗數/花藥誘導出的愈傷組織數×100%;所得數據采用excel軟件進行方差分析,p<0.05水平上分析各處理的差異顯著性,結果如表1。
表1不同激素配比對馬鈴薯花藥愈傷組織分化及出苗的影響
將誘導出的愈傷組織置于含有不同植物激素的分化培養基中,60-80d后統計結果表明,僅在實施例1~3激素組合處理中,5個品種愈傷組織均可分化出綠芽,其中,實施例3最高,5個品種分化率達到6.1~16.9%,繼代培養30d后,5個品種的出苗率達到21.7~43.9%。
實施例5
將馬鈴薯品種青薯168、黑美人、中薯19、莊薯3號、隴薯6號、寧薯14和寧薯15共7個品種進行雙單倍體群體構建。
(1)選擇現蕾至初花期取長度為4-6mm的花蕾,放置4℃冰箱預處理5d。將處理好的材料在超凈工作臺無菌環境下,將花蕾先置于75%酒精溶液中表面滅菌30s,隨后轉入0.1%升汞溶液中滅菌8min,再用無菌水沖洗3次,每次2min。滅菌后置于無菌濾紙上,用鑷子與接種針將花藥從花蕾中剝離出,接種于盛有誘導培養基的50ml三角瓶中,每瓶放15枚花藥,封口膜封口。
(2)誘導培養基由ms培養基、附加物、植物激素三部分成分組成。ms培養基參照murashige&skoog(1962)的方法配制,附加物為硝酸銀30mg/l,活性炭3g/l,蔗糖6%(w/v),瓊脂0.6%(w/v);添加的植物激素組合為:1mg/l2,4-二氯苯氧乙酸(2,4-d),0.5mg/l萘乙酸(naa),1mg/l激動素(kt)。采用高壓滅菌,滅菌壓力為1.2kg/cm2,溫度為121℃,滅菌時間為15min。
(3)將接種后的花藥置于35℃恒溫培養箱中黑暗培養72h,隨后轉入24℃、黑暗條件下誘導培養45d后,挑取花藥裂縫處形成白色或淡黃色愈傷組織轉入分化培養基中分化培養60-80d,光照條件為光照16h/黑暗8h,培養溫度為24℃;選擇分化出綠色芽點的愈傷組織轉入分化培養中繼代培養30d,光照條件為光照16h/黑暗8h,培養溫度為24℃;分化培養基及繼代培養基為實施例1~3與對比例1~3制備的分化培養基。
(4)待繼代分化出的小苗長至2片小葉時,轉入生根培養基中生根培養30d,光照條件為光照16h/黑暗8h,培養溫度為24℃。當花藥培養植株葉片長至7~8片,根長為4~5cm時,經倍性鑒定后即可煉苗及移栽。
花藥培養植株的倍性鑒定
倍性鑒定是作物遺傳育種中必不可少的步驟,以往的倍性鑒定主要采用染色體計數法。盡管染色體計數鑒定倍性可靠性高,但操作復雜,不易掌握,鑒定速度慢,且當染色體數目太多時也可能造成誤差。利用染色體倍性分析儀(流式細胞儀)通過比較并分析細胞核dna含量來鑒定倍性,不僅樣品易取得、用量少,且樣品處理方法更為快速簡單,檢測結果更加準確等,目前已成為花藥培養植株早期鑒定的主要技術之一。
細胞核懸液制備及染色:剪取花藥培養植株葉片1.0cm2,在滴有0.4ml提取液緩沖液的培養皿中研碎,加入1.6ml染色緩沖液,染色3~5min;500目尼龍網過濾,濾液用標準試管收集,隨即上機測定。
流式細胞測定:所用機型為partec公司生產的
2013-2015年,對寧夏地區種植的7個馬鈴薯品種按照本方法進行了花藥培養,7個品種均誘導出愈傷組織,愈傷組織誘導率達到8.0~31.7%;其中5個品種(系)的可成功分化誘導出花藥植株,分化率達到6.1~16.9%。通過倍性分析儀的鑒定,篩選獲得了雙單倍體植株。因此,本方法的進一步應用將為馬鈴薯倍性育種研究提供重要的理論與實踐。
實施例6
將實施例3的方案中誘導培養基替換為如表2中10組不同植物激素與附加物組合形成的誘導培養基,采用實施例3的方法誘導,得到的愈傷組織統計結果如表2。
表2不同植物激素組合形成的誘導培養基
注:愈傷組織誘導率(%)=形成愈傷組織的花藥數/接種花藥數×100%
表3不同激素組合對馬鈴薯花藥愈傷組織誘導的影響
將7個馬鈴薯品種的花藥接種于10種激素組合處理的培養基中進行愈傷組織誘導培養,30d左右可以觀察到花藥裂縫處形成白色或淡黃色愈傷組織出現,40-50d后統計愈傷組織誘導率。由表3可知,不同激素組合處理對馬鈴薯花藥愈傷組織誘導差異顯著,以激素組合6處理下的誘導率相對較高。7個品種愈傷組織誘導率達到8.0~31.76%。其中寧薯15號最高,達31.76%。
實施例7
將實施例3的方案中誘導培養基替換為如表4中10組不同附加物與植物激素組合形成的誘導培養基,采用實施例3的方法誘導青薯168品種,得到的愈傷組織統計結果如表5。
表4馬鈴薯花藥培養附加物組合
表5附加物組合對青薯168花藥愈傷組織誘導的影響
以青薯168品種為試驗材料,對添加6號激素組合的誘導培養基中添加9種附加物組合處理,30d后統計結果表明,不同組合附加物處理對馬鈴薯花藥愈傷組織具有顯著差異,其中v、ⅵ處理下誘導率最高,分別達到25.0%和21.25%。
以上所述僅是本發明的優選實施方式,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!