miR?375?3p在鱗翅目害蟲防治中的應用的制作方法與工藝
miR-375-3p在鱗翅目害蟲防治中的應用技術領域本發明涉及miR-375在斜紋夜蛾防治中的應用,具體涉及miR-375-3p抑制斜紋夜蛾抗植物毒素機制從而達到高效殺蟲這一功能,從而圍繞miR-375-3p開展轉基因或抑制劑研發,達到高效害蟲防治的目的。
背景技術:
microRNA(miRNA)為20世紀90年代發現的一類內源性的非編碼RNA(LeeRC,FeinbaumRL,AmbrosV.TheC.elegansheterochronicgenelin-4encodessmallRNAswithantisensecomplementaritytolin-14.Cell,1993,75(5):843-54.),約22個核苷酸。它們的生物合成由RNA聚合酶II(RNApolymeraseII,polII)轉錄,形成長度為幾百甚至上千個堿基的初級轉錄本(pri-miRNA),其中pri-miRNA的5’端具有帽子結構和poly(A)尾巴。pri-miRNA于細胞核內在RNaseIII的作用下,被剪切生成miRNA前體(pre-miRNA)。前體miRNA通過Ran-GTP介導的exportin-5蛋白轉運到細胞質中(BartelDP.MicroRNAs:genomics,biogenesis,mechanism,andfunction.Cell,2004,Vol.116(2):281-297)。在RNaseIII/Dicer復合體的作用下,pre-miRNA被剪切成兩個不完全配對的miRNA和miRNA*(miRNA*就是與miRNA不完全互補配對的序列)。最后在解旋酶的作用下miRNA/miRNA*復合體解旋形成成熟單鏈的miRNA。成熟的miRNA會與沉默復合體(RISC)結合,而剩下的miRNA*在細胞質中被RNase所降解。miRNA作用機制主要包括兩點:抑制翻譯和降解mRNA。miRNA與靶mRNA的3’UTR不完全互補配對進而破壞靶基因mRNA轉錄本的穩定性,從而達到抑制核糖體翻譯的目的。而降解作用則是通過加速靶mRNA中的多聚腺苷酸尾巴(poly(A)tail)去腺苷酸化,使mRNA的結構被破壞,導致mRNA失去保護而迅速被核酸外切酶降解。就目前研究而言,miRNA對靶基因mRNA的翻譯抑制和對靶基因mRNA的加速降解是兩個相互獨立的機制,不僅如此,這兩個不同的機制所產生的結果也有明顯的區別:miRNA對mRNA的降解是一個不可逆的過程,一旦被降解就徹底地消失了;但是,miRNA對mRNA翻譯的抑制卻是可以被解除的調控(WuL,FanJ,BelascoJG.MicroRNAsdirectrapiddeadenylationofmRNA.ProcNatlAcadSciUSA,2006,Vol.103(11):4034-4039.)。大量的研究工作表明,miRNA具有調控生物體生長和發育,細胞分化和凋亡,激素的分泌和信號的傳導以及應答各種脅迫。但是在昆蟲與植物關系中的重要miRNA仍沒見有報道。斜紋夜蛾是一種雜食性昆蟲,可以進食290多種植物,對農業生產影響很大,研究調控其進食植物的重要miRNA對發展害蟲防治新靶標有著重要的意義。
技術實現要素:
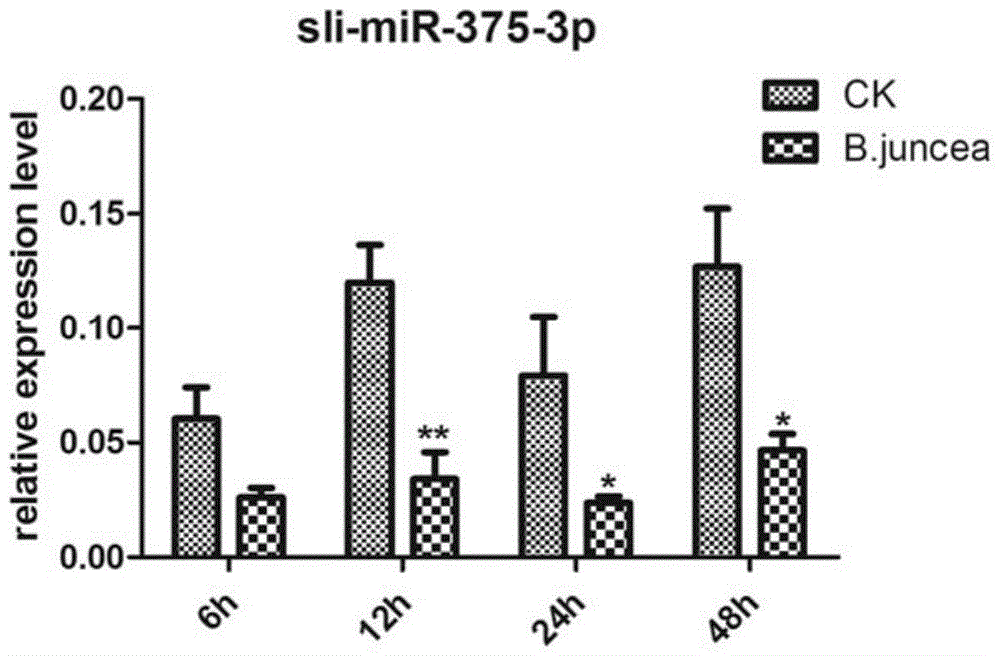
本發明的目的在于提供昆蟲miR-375-3p在制備殺蟲劑中的應用。本發明所采取的技術方案是:昆蟲類miR-375-3p在制備殺蟲劑中的應用。進一步的,上述昆蟲為鱗翅目昆蟲。進一步的,上述鱗翅目昆蟲為斜紋夜蛾、蠶、茶尺蠖、小菜蛾、草地貪夜蛾、水稻二化螟。進一步的,上述昆蟲類miR-375-3p的序列如SEQIDNO:1所示。本發明的有益效果是:本發明發現斜紋夜蛾類miR-375-3p可有效防治斜紋夜蛾,該序列在別的鱗翅目昆蟲內也存在,高度保守,因此也可用于防治其他害蟲。本發明發現斜紋夜蛾miR-375-3p可用于任何鱗翅目昆蟲的害蟲防治,同理,任何鱗翅目昆蟲的miR-375-3p皆可用于其他同類昆蟲的害蟲防治。附圖說明圖1為注射miR-375-3p后斜紋夜蛾幼蟲的生長情況;圖2為qRT-PCR分別檢測進食芥菜和人工培養基后斜紋夜蛾中腸miR-375-3p的表達水平,CK代表培養基對照,B.juncea為芥菜;圖3為qRT-PCR檢測進食培養基斜紋夜蛾不同組織中miR-375-3p的表達情況并與斜紋夜蛾細胞株進行比較;FB:脂肪體;spli221:斜紋夜蛾細胞株;mg:中腸;head:頭部;EP:表皮;圖4為qRT-PCR檢測相關基因的表達與miR-375-3p之間的關系;圖5為western檢測注射了miR-375-3p斜紋夜蛾幼蟲體內蛋白GSTE1的表達量;圖中NC表示對照組,給幼蟲體內注射的序列為SEQIDNO:2;375mimic表示處理組,給幼蟲體內注射的序列為SEQIDNO:1;圖6為家蠶幼蟲體內注射斜紋夜蛾miR-375-3p72h的表征;左邊三條蟲體為注射NC序列后的表型,右邊三條蟲為注射斜紋夜蛾miR-375-3p后的表型,其中間一條為死亡蟲;圖7為不同物種的miR-375-3p序列比較;其中,序號1-13包括了人、哺乳動物和昆蟲;15-19為鱗翅目昆蟲;圖8為不同物種miR-375-3p聚類圖。具體實施方式本發明將5齡大的斜紋夜蛾喂食其喜好的芥菜,然后提取其消化吸收主要場所中腸的RNA,通過高通量測序分析,并與已有數據庫數據進行比對分析,確定了有差異表達的163個miRNA。對其中幾個表達量顯著下調的miRNA進行了人工序列合成,并注射入5齡大的斜紋夜蛾,結果發現miR-375-3p顯著抑制斜紋夜蛾的生長,注射后一天,昆蟲死亡率增加了約70%。表明MiR-375-3p對斜紋夜蛾防治的有效性。目前miR-375-3p在人類胰島素代謝,癌癥,細胞凋亡等途徑中都有報道參與調控,在昆蟲中只有一篇報道,在蚊子吸血后miR-375-3p表達上升。miR-375-3p通過抑制人類磷脂酰肌醇依賴性激酶1,從而抑制胰島素的分泌的(OuaamariA,BaroukhN,MartensGA,LebrunP,PipeleersD,vanObberghenE.miR-375targets3'-phosphoinositide-dependentproteinkinase-1andregulatesglucose-inducedbiologicalresponsesinpancreaticbeta-cells.Diabetes.2008,57(10):2708-17.),但我們發現斜紋夜蛾miR-375-3p并不作用胰島素分泌過程的相關基因,而是作用一些免疫基因。下面結合具體實施例對本發明作進一步的說明,但并不局限于此。實施例1一、miR-375-3p處理影響斜紋夜蛾的生長選取大小一致、健康狀況一致的五齡第一天斜紋夜蛾幼蟲,稱量每只蟲子的重量,隨機分為miR-375-3p處理組和NC對照組,每組40只,重復3次。順血液循環流動方向,用微量注射器從斜紋夜蛾幼蟲的側腹部第一和第二腹足之間,分別注射人工合成的miR-375-3p,序列為5’-UUUGUUCGCCCCGGCUCGAGUCG-3’(SEQIDNO:1)和NC:5'-UUCUCCGAACGUGUCACGU-3’(SEQIDNO:2),已知的不作用任何基因的無義小分子片段;注射量為每只蟲4μg,注射后喂飼芥菜。注射后第1、2、3天觀察蟲子的形態變化并拍照取證,每天統計蟲子的死亡率。表1注射miR-375-3p后斜紋夜蛾幼蟲的死亡情況實驗結果如表1和圖1所示,從表1中可以看出注射miR-375-3p的處理組在注射24后,死亡率達68.97%,遠遠高于對照組的7.14%,72小時后死亡率達86.21%,而對照組僅為10.71%。圖1為注射miR-375-3p和NC3天后斜紋夜蛾幼蟲的生長情況,從中可以看出miR-375-3p處照后存活的幼蟲瘦小,而對照組的幼蟲明顯肥大許多。二、MiR-375-3p在斜紋夜蛾進食芥菜時表達量下降將五齡第二天的斜紋夜蛾分別分為兩組,一組繼續喂食人工培育基作為對照,另一組改喂食芥菜,分別于喂食芥菜后6、12、24和48h取斜紋夜蛾中腸進行miR-375-3p含量的測定,測定方法為qRT-PCR。并且,對喂食芥菜的斜紋夜蛾中脂肪體(FB)、中腸(mg)、頭部(head)、和表皮(EP)中miR-375-3p的表達量進行檢測,并與斜紋夜蛾細胞株(spli221)中miR-375-3p表達量進行比較。從圖2中可以看出,進食芥菜6h后,與進食培養基的斜紋夜蛾相比,進食芥菜組的中腸miR-375-3p含量顯著下降。因此如果此時注射大量miR-375-3p將抑制相關基因的表達,而導致斜紋夜蛾的死亡(表1和圖1)。從圖2和圖3中可以看出,五齡第二天的斜紋夜蛾改喂食芥菜后,miR-375-3含量顯著下降。它是通過自身對miR-375-3p的降解,解除了對靶基因的抑制作用,從而促進了靶基因的表達上調,從而響應芥菜的進食。圖3分析了miR-375-3p在各組織的分布,其含量在脂肪體最高,暗示其可能與斜紋夜蛾的免疫功能有關。三、miR-375-3p通過調控免疫相關基因響應斜紋夜蛾進食芥菜為了了解miR-375-3p可能的靶基因,本發明對斜紋夜蛾進食芥菜的中腸進行了高通量測序,通過分析,發現表達量上調顯著的基因多與免疫和生長有關,將這些顯著上調基因的3’末端序列與miR-375-3p進行配對,最后挑出結合可能性高的靶基因(自由能ΔG<-19)。如下表2所示,miR-375-3p與多個二相解毒酶如GST和UGT、抗氧脅迫基因如氧化還原酶和轉錄因子Ets、參與代謝的蛋白水解酶和脂肪酶等。表2高通量測序法篩選miR-375-3p可能的靶基因為了進一步研究表2中篩選出的靶基因與miR-375-3p的關系,將斜紋夜蛾幼蟲注射miR-375-3p并喂食芥菜72h后,對斜紋夜蛾幼蟲中腸進行qRT-PCR,以檢測這些靶基因的表達情況。qRT-PCR方法:喂食芥菜的蟲子解剖,取中腸、前腸、后腸、脂肪體、表皮、血淋巴等組織,按Trizol法抽提總RNA,測定濃度后取2μg總RNA進行反轉錄(參考TAKARA的OneStepPrimeScriptmiRNAcDNASynthesisKit說明書進行),得到的cDNA產物稀釋后用于熒光定量PCR的模板,按照說明書進行qRT-PCR。采用相對定量的方法(2?ΔΔCt)來確定目標基因相對內標基因(GAPDH,HQ012003)的相對表達倍數。應用SPSS16.0統計分析軟件,采用ANOVA(多個處理間的兩兩比較)或獨立樣本T檢驗(兩個樣品間比較)來進行處理間的差異比較分析。實驗結果如圖4所示,從中可以看出,在注射miR-375-3p的斜紋夜蛾幼蟲體內,蛋白水解酶chymotrypsin-likeprotease、解毒酶UGT和GSTe1表達量顯著下調,說明miR-375-3p在體內抑制這些基因的表達。本實施例還用western方法作進一步檢測,將斜紋夜蛾幼蟲注射了miR-375-3p后再喂食芥菜,然后分別在注射24h、48h后提取斜紋夜蛾中腸蛋白,用western方法檢測目的蛋白GSTE1(解毒酶)的表達量。檢測結果如圖5所示,從結果可以看出在處理組(注射了miR-375-3p斜紋夜蛾幼蟲體)中GSTE1蛋白表達水平明顯低于對照組(NC),說明miR-375-3p抑制GSTE1蛋白表達。而正常情況下該蛋白在斜紋夜蛾進食芥菜后表達量上調。實施例2Sl-miR-375-3p對家蠶生長發育的影響既然miR-375-3p在鱗翅目昆蟲較保守,那么斜紋夜蛾Sl-miR-375-3p是否同樣影響其他鱗翅目昆蟲的生長發育?為此對家蠶5齡幼蟲進行了同實施例1中“一”相似的注射實驗,注射后觀察蟲子的形態變化并拍照取證,每天統計蟲子的死亡率。檢測結果如圖6所示,可以看出注射2ug斜紋夜蛾Sl-miR-375-3p后的家蠶100%生長不正常,蟲體瘦小,72h后,死亡率達54%(見表3)。表3注射斜紋夜蛾miR-375-3p的家蠶死亡率統計下面將斜紋夜蛾Sl-miR-375-3p序列與鱗翅目其他昆蟲的miR-375-3p序列進行比較,同時與其他物種(如人、哺乳動物)的miR-375-3p序列進行比較,比較結果如圖7和圖8所示。從圖7中可以看出鱗翅目昆蟲中小菜蛾(Plutellaxylostella)、家蠶(Bombyxmori)和水稻二化螟(Chilosuppressalis)的miR-375-3p序列完全一樣,而草地貪夜蛾(Spodopterafrugiperda)和斜紋夜蛾(Spodopteralitura)的miR-375-3p序列完全一樣,兩組鱗翅目昆蟲間的miR-375-3p序列只有一個堿基的差異,一個為U,另一個為A。而鱗翅目昆蟲的miR-375-3p序列與別的物種差別較大。從圖8中可以看出鱗翅目昆蟲miR-375-3p聚為一類,而與其他物種差距較大。上述結果說明,miR-375-3p抑制蟲體內用于消化食物所需的解毒酶和代謝酶的表達,從而影響蟲體進食,最終導致蟲體的瘦小甚至死亡。斜紋夜蛾miR-375-3p可用于任何鱗翅目昆蟲的害蟲防治。同理,任何鱗翅目昆蟲的miR-375-3p皆可用于其他同類昆蟲的害蟲防治。可將昆蟲miR-375-3p用于殺蟲劑的制備,或制備表達miR-375-3p的轉基因植物進行害蟲防治。為本領域的專業技術人員容易理解,以上所述僅為本發明專利的較佳實施例,并不用以限制本發明,凡本發明的精神和原則之內所作的任何修改、等同替換和改進等,均落在本發明要求的保護范圍之內。<110>華南師范大學<120>miR-375-3p在鱗翅目害蟲防治中的應用<130><160>2<170>PatentInversion3.5<210>1<211>23<212>RNA<213>人工序列<400>1uuuguucgccccggcucgagucg23<210>2<211>19<212>RNA<213>人工序列<400>2uucuccgaacgugucacgu19
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1